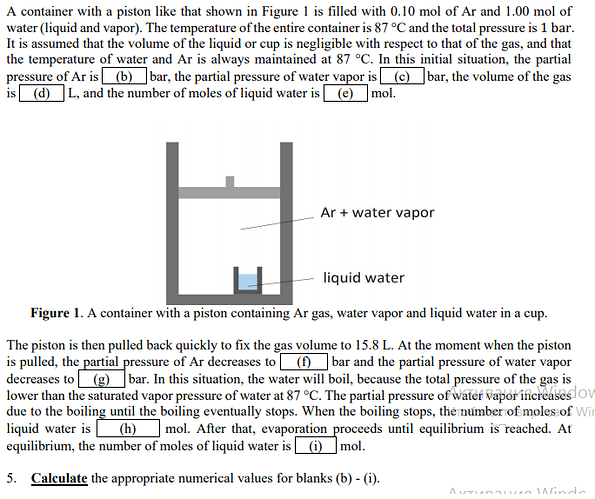
- В некотором контейнере над сосудом с жидкой водой находится смесь водяных паров и аргона с общим давлением 0.5 бар, в то время как давление насыщенного водяного пара при постоянной температуре контейнера составляет 0.63 бар. Почему жидкая вода должна кипеть до того, как общее давление водяного пара и аргона не сравнится с давлением насыщенного водяного пара ?
- Почему вода не может просто испариться до тех пор, когда парциальное давление водяного пара не станет 0.63 бар ?
- Говорят, что фазовый переход происходит при постоянном давлении. Но когда вода кипит, давление ведь постепенно увеличивается, что противоречит предыдущему утверждению. В чем моя ошибка ?
Растворение газа это же растворение под давлением. Если нет давления, то газ вырывается из раствора. Она так может пока давление не достигнет 0,63 бар.
Наверно причина это одинаковое действие давления от аргона и от водяного пара. Поэтому она зависит от общего давления, а не от давления пара воды
Если я правильно понял, то здесь частично элементы какой-то задачи. Можешь скинуть условие? Что бы лучше понимать контекст вопроса
Обычно когда речь идёт о кипении, дело происходит в открытой системе. По крайней мере, я никогда не думал о кипении в закрытой или изолированной.
Так вот, в таком случае действительно за счёт увеличения количества молекул в газовой фазе давление должно повышаться. Только речь идёт про атмосферу, в которой количество молекул чудовищное, и пара моль воды, которое добавится, изменит давление на пренебрежимо малое значение. Поэтому мы и считаем, что давление постоянное.
Если не ошибаюсь это Preporatory problems 2021 , 2 задача
Промазал
Энивей.
Потому что это условие для механического (фазового равновесия). Когда p_1 = p_2.
Иными словами, что такое давление насыщенного пара? Это давление испарённой жидкости над чистым раствором собственно той самой жидкости. Теперь поговорим о динамике: допустим мы некий сосуд, внутри которого вакуум, частично заполняем жидкостью. Что происходит? Молекулы жидкости потихоньку переходят в газовую фазу до тех пор, пока давление газовой фазы не будет предотвращать дальнейшее испарение. Точкой равновесия и будет давление насыщенного пара.
Что будет если изначально в сосуде был не вакуум а некоторое количество иного газа? Молекулам не важно какие молекулы газа мешают им испаряться, им важно общее внешнее давление. Поэтому вода будет кипеть до тех пор, пока внешнее давление не будет соответствовать чистому внешнему давлению водяного пара, которое в данном случае будет складываться из двух факторов.