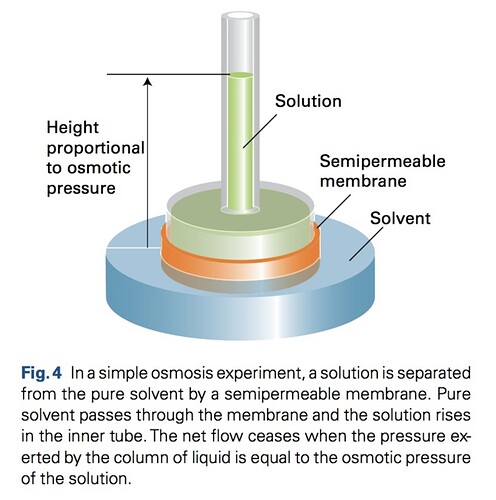
В последнем предложении говорится «осмотическое давление раствора», хотя до этого вроде упоминали, что осмотическое давление задает чистый растворитель. Допустим вот граница (мембрана) между растворителем и раствором. 1. Раствор сверху, а растворитель снизу?
2. Зачем растворителю поднимать раствор, как он может давить вверх? Типа не должен ли он давить вниз
3. Равновесие достигается когда давление столба раствора (то есть он давит вниз?) равно давлению растворителя, который давит вверх раствор?
Судя по картинке, да (ну, потому что solvent - растворитель, solution - раствор)
Поскольку x_{solvent}<1 , химический потенциал растворителя в растворе всегда меньше химического потенциала чистого растворителя. Это означает, что чистый растворитель имеет тенденцию переходить через мембрану в раствор (\Delta G этого процесса меньше нуля). Поэтому растворитель поднимает раствор, а давит он вверх чисто из-за того, что в раствор добавляется определенное кол-во растворителя, и молекулам ничего не остается, кроме как занимать всевозможное пространство (иначе куда деть добавленные молекулы растворителя?)
Да, должен, поскольку с увеличением высоты столбика раствора, увеличивается и гидрастатическое давление (p_{hyd}=pgh). Но здесь весь прикол в том, что увеличение гидрастатического давления увеличивает общее давление, что в свою очередь увеличивает химический потенциал растворителя в растворе. Но в то же время, из за того, что раствор на то и есть раствор, что в нем содержатся другие компоненты помимо растворителя, уменьшение мольной доли растворителя от 1 до x_{solution} уменьшает химический потенциал растворителя в растворе. Суть заключается в том, чтобы рассчитать такое гидрастатическое давление, которое балансирует эти два эффекта так, чтобы химический потенциал растворителя в растворе сравнился с химическим потенциалом чистого растворителя. Это и будет осмотическим давлением, которое необходимо будет приложить раствору, чтобы не возникал этот феномен.
Это было бы справедливо, если бы раствор содержал только растворитель. А поскольку такое невозможно, справедливо сказать, что равновесие достигается только тогда, когда гидростатическое давление компенсирует уменьшение хим.потенциала за счет уменьшения мольной доли растворителя в растворе до значения μ_{solvent}^{*}
Вопрос со звездочкой ![]() : Если условие термодинамического равновесия между двумя подсистемами это равенство температур, хим.потенциалов и давления. То почему хим.потенциал оказался важнее давления?
: Если условие термодинамического равновесия между двумя подсистемами это равенство температур, хим.потенциалов и давления. То почему хим.потенциал оказался важнее давления?
А это случаем не работает только для чистых веществ?
Типо допустим жидкость А в равновесии со своими парами, хим.потенциал должен быть равным как для жидкого, так и для газообразного А.
А тут у нас также имеется 2 отдельные фазы, со своими хим. потенциалами, только во второй фазе(растворе) появился левый чел Б, которого никто не ждал, и которого не учитывали в условии, а значит для этого случая некоторые вещи будут работать по другому.
Это лишь предположение, мне бы хотелось услышать настоящий ответ.
Для смесей тоже работает, оттуда выводятся закон Рауля, колигативные свойства, зависимость фазового перехода от давления и т.д.
Нет ![]()