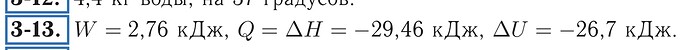W=-pdV, где V1 это nRT/p, а как быть с V2? Не нужно ли знать плотность жидкого брома , чтобы найти V2?. Правильно ли, что процесс изобарический и что я беру p как 101,325 кПа?
да, поскольку в изотермическом процессе конденсации бора работа dW=-pdV является работой против внешнего атмосферного и давления самих паров. Давление паров равно атмосферному (для механического равновесия) (на самом деле не в курсе почему для 59 градусов это, но например точка кипения воды равна 100 градусам как раз потому, что при этой температуре давление паров равно атмосферному), так что p можно брать как 101325 Па. Объём V_2 знать необязательно, так как удельный объём пара гораздо больше удельного объёма жидкости
Реакция процесса:
Нам известно что V_{(gas)} больше чем V_{(liquid)}. Реакция для этого процесса:
найдем работу для этого процесса через -p\Delta V где \Delta V=-V_{(газа)} . Объем газа можно найти через уравнение менделеева-клапейрона. При конденсаций одного моля брома эта теплоты, выделяется в окр. среду значит q=-q_{(испарения)}\cdot M_r
Можно сделать так: процесс изотермический, поэтому если газ считать идеальным, то \Delta U = 0. По первому закону \Delta U = Q + A, значит A = -Q. Теплоту можно легко найти с помощью удельной теплоты испарения, осталось только найти энтальпию. Поскольку в процессе не меняется давление, \Delta H = \Delta U + p \Delta V = Q.
Так, ну если рассуждать с глубин, то можно представить что сначала происходит изотермическое сжатие 59° . Работа выполняется PV или nRT. Но по условию также происходит фазовый переход брома из пара в жидкость , что спаньсируется теплотой равной -Ткип*Ммасса
А, я сглупил, попытался использовать зависимость внутренней энергии для идеального газа для фазового перехода. По-моему, здесь давление не обязательно равно 1 атм, потому что фазовое равновесие может быть достигнуто при разных давлениях в зависимости от температуры. Но для решения задачи знать давление не нужно — оно сократится при расчете работы.
Решение, предложенное @DiasTaraz, верно. К нему надо только добавить, что при постоянном давлении \Delta H = Q.