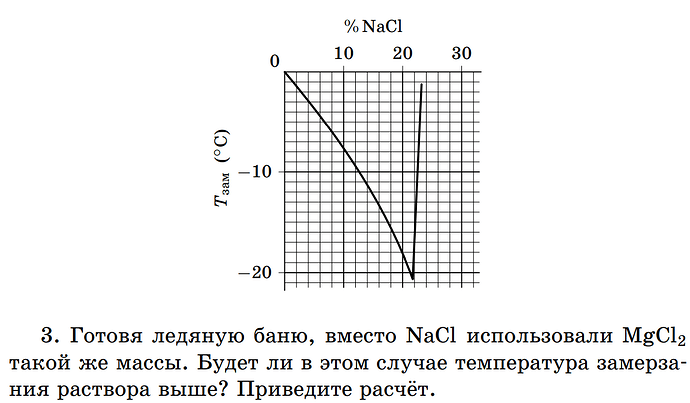
3. Готовя ледяную баню, вместо NaCl использовали MgCl_2 такой же массы. Будет ли в этом случае температура замерзания раствора выше? Приведите расчет.
Подскажите, правильные ли у меня рассуждении?
Получается что, у нас происходит такой процесс : лед + соль → раствор в каком-то количестве
Если у нас образуется раствор, то происходит диссоциация солей, представим обе случая :
\ce{NaCl} \rightarrow \ce{Na^+} + \ce{Cl^-}
\ce{MgCl2} \rightarrow \ce{Mg^{2+}} + 2\ce{Cl^-}
Теперь запишу я выражение для изменении температуры :
T^* - стандартная температура замерзании-плавлении
Данное изменение температуры будет зависеть от моляльности. В данном случае моляльность у нас связано с молями ионов? Тогда будет вот такое выражение
Теперь мы принимаем, что масса льда 1кг, а масса солей по 150г.
Тогда :
b_B (\ce{NaCl}) (для ионов) =5,13\frac{mole}{kg}, b_B(\ce{MgCl2}) (для ионов)= 4,737 \frac{mole}{kg}
T^* = 0\cdot C
Тогда выражение будет таким :
А как дальше? Мне кажется я решил задачу на процентов так 90, но не добил. А еще такой вопрос, эту задачу стоит решать с учетом диссоциации или без нее?