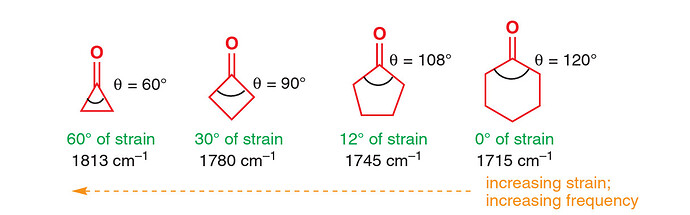
В книге говорится:
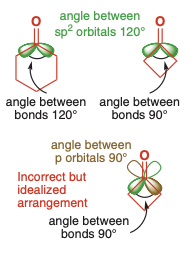
Из за того что в маленьких кольцах( циклобутан, циклопропан) углы не соответствуют углам sp2 гибридизаций, перекрывание с соседними углеродами плохое и из за этого C=O связь прочнее( лежит в IR регионе тройной связи ).
Вопрос:
Kак плохое перекрывание между соседними углеродами влияет на прочность связи C=O?
Какие именно предложения из этого объяснения вам не понятны?

1 лайк
Я не правильно перевёл, только сейчас понял что там написано.
1 лайк
Мы тут посчитали “гибридизацию” во всех случаях и вот результат:
Назовем карбонильный углерод C. Назовем углероды в кольце слева и справа от этого карбонильного углерода как С(RL).
| Размер кольца | Гибридизация C | Гибридизация C(RL) |
|---|---|---|
| C3 | sp^{1.53} | sp^{3.7} |
| C4 | sp^{1.72} | sp^{3.5} |
| C5 | sp^{1.81} | sp^{3.32} |
| C6 | sp^{1.9} | sp^{3.13} |
4 лайка