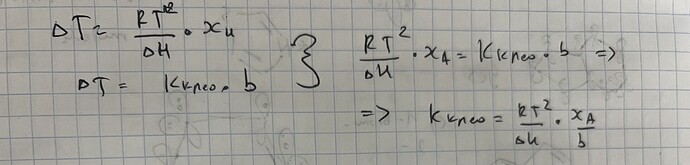Ну, сперва представим систему, в которой вода существует в виде льда и жидкости при 1 атм и температуре T_о (273.15 К). Думаю довольно справедливо сказать, что \Delta_{пл}G(T_о) = 0. Представим что мы растворили некоторое количество вещества В в этой системе, и тогда равновесное состояние в этой системе при таком же давлении 1 атм достигается при температуре T. Напишем выражение для химического потенциала жидкой воды при этих условиях:
\mu_\ce{A}(ж,T) = \mu_\ce{A}^*(ж,T) + RT\ln x_\ce{A}
Стоит отметить, что \mu_\ce{A}(ж,T) = \mu_\ce{A}^*(тв, T) (вспомним про равновесие), тогда
\mu_\ce{A}^*(тв, T) = \mu_\ce{A}^*(ж,T) + RT\ln x_\ce{A}
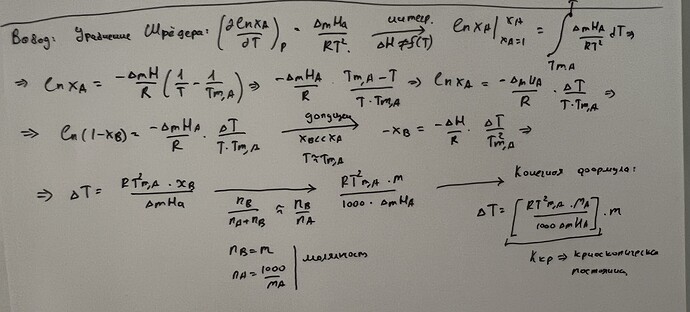
\Delta G_{пл}(T) = -RT\ln x_А ; \ \ln x_А = -\frac{\Delta G_{пл}(T)}{RT}
Пока что мы принимаем за данность то, что T < T_о. Поскольку x_А < 1, \Delta G_{пл}(T) > 0, что довольно логично, если посмотреть на фазовую диаграмму воды (давление мы принимаем за константу, и тогда по фазовой диаграмме видно, что при температуре T < T_о термодинамически стабильной фазой воды является лед). Если \Delta_{пл}G(T_о) = 0, то довольно справедливо, что \displaystyle \frac{\Delta_{пл}G(T_о)}{RT_о} = 0. В таком случае,
\ln x_А = \frac{\Delta G_{пл}(T_о)}{RT_о} - \frac{\Delta G_{пл}(T)}{RT}
Поскольку выражение для химического потенциала выводится с помощью закона Рауля (который справедлив только для случаев, когда в систему было добавлено очень маленькое количество вещества В), можно сказать, что новая температура плавления не должна сильно отличаться от нормальной температуры плавления, а посему можно допустить, что изменения энтальпии и энтропии плавления не зависят от температуры в рассматриваемом случае.
\ln x_А = \frac{\Delta H_{пл}}{R}(\frac{1}{T_о} - \frac{1}{T}) = \frac{\Delta H_{пл}}{R} \frac{T-T_о}{T_оT}
Раз уж новая температура плавления не сильно отличается от нормальной, то T_оT \approx T_о^2. Также, поскольку x_А = 1 - x_В, можно в конечном итоге придти к следующему выражению:
\ln (1-x_В) = \frac{\Delta H_{пл}(T- T_о)}{RT_о^2}
Поскольку x_В довольно близка к нулю, можно использовать локальную линейную аппроксимацию. Рассмотрим график функции f(x_В) = \ln (1-x_В) и касательную в точке x_B = 0:
Как можно заметить, если значение
x_В довольно близко к нулю, то можно использовать касательную, чтобы аппроксимировать значение функции. Так как
\displaystyle\frac{df(x_В)}{dx_В} |_{x_В =0} = -1, можно сказать, что
f(x_В) \approx -x_В в окрестности нуля. В таком случае,
x_В = \frac{\Delta H_{пл}(T_о - T)}{RT_о^2}
T_о - T = \Delta T = \frac{RT_о^{2}}{\Delta H_{пл}} x_В
И наконец, \displaystyle m_В = \frac{n_В}{m_{\ce{H2O}}} = \frac{n_В}{n_{\ce{H2O}}}\cdot \frac{1}{M(\ce{H2O})}. Так как вещество В находится в очень маленьком количестве, \displaystyle x_В = \frac{n_В}{n_В + n_{\ce{H2O}}} \approx \frac{n_В}{n_{\ce{H2O}}}. В конечном итоге,
\Delta T = \frac{RT_о^2 M(\ce{H2O})}{\Delta H_{пл}} \cdot m_В
Если подставить необходимые данные, то вроде как должно получиться значение 1.86 для криоскопический константы для воды.