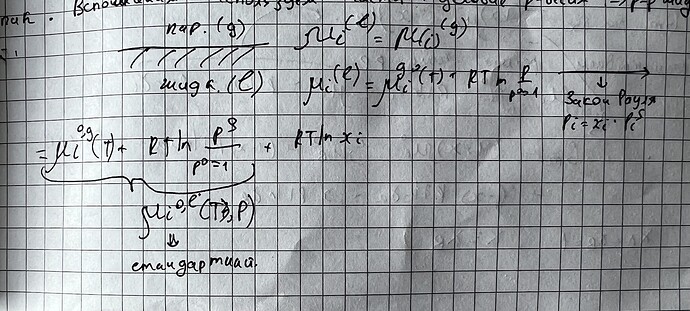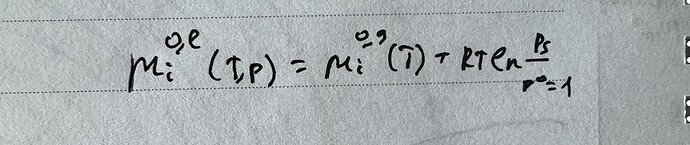У меня не получается вывести \Delta T=Kb.
Имеем
Дальше просто заменяю энергию Гиббса на хим. потенциал, не понимая в чем разница. Возможно тут и пошла моя ошибка. Прошу шарящих объяснить в чем отличие.
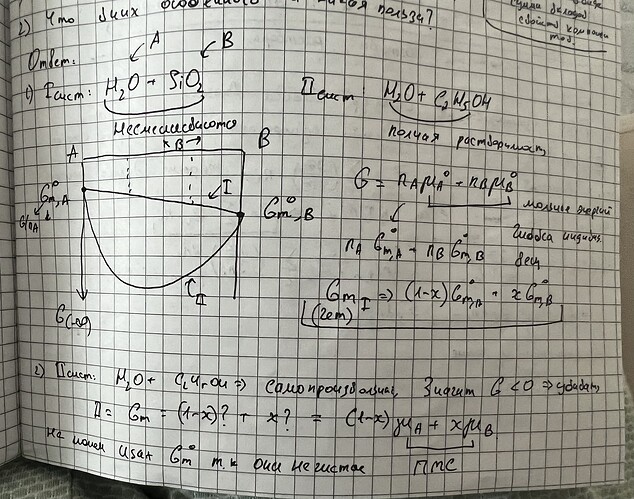
Вот допустим есть у меня чистое вещество А, жидкость в равновесии с насыщенным паром. Так как пары в равновесии, \mu_{l}^*(p^*)=\mu_g^*(p^*). Поставил звездочку чтобы показать что он чистый. p^*- это давление насыщенных паров.
В скобках я указываю при каком давлении имеется ввиду.
Дальше представим что добавляем какую-то соль, и давление больше не чистое, падает до p. \mu_l^*(p^*) падает до \mu_l(p), \mu_g^*(p^*) падает до \mu_g(p).
Выражу \mu_g^\circ из (1) и вставлю в (2):
Так как по закону Рауля p=p^*\chi_A, где \chi_A- мольная доля А в жидкой смеси:
Дальше вроде делают так
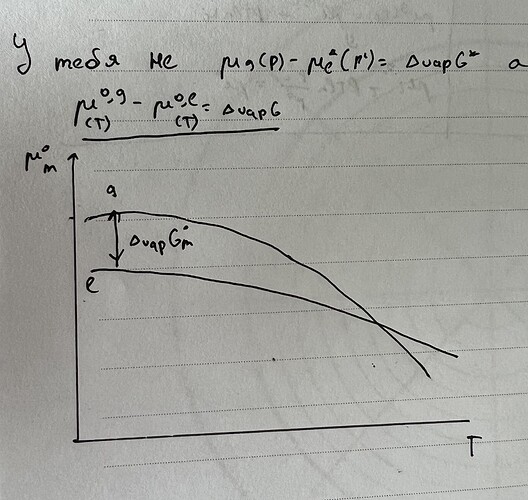
Но два хим. потенциала же при разных давлениях, нельзя сказать что разность слева — это \Delta_{\text{vap}}G^*. Что не так я сделал?