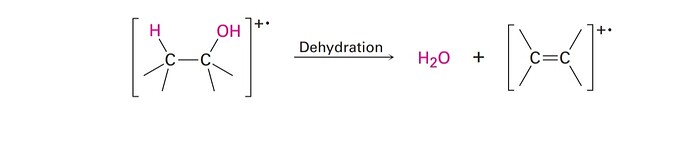
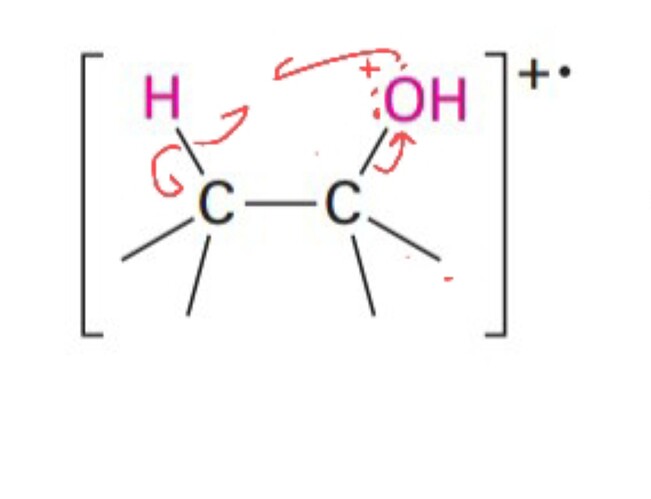
Как здесь образовалась двойная связь?
У нас же у одного углерода лишь один электрон будет,а второй будет соответственно положительно заряженным
Или у меня мех не правильный?
“Палочка” это пара электронов. Поэтому тебе достаточно одной стрелки слева в центр. А вот связь С-H это пара уходит и становится пи-связью
Вы кажется не поняли моего вопроса.После альфа расщепления образовался катион-радикал,электрон оказался на атоме кислорода.Так вот ,в книге написали что идет Е2 элиминирование,но мне не понятно как
А, не сразу увидел радикал. Ну тогда в принципе всё остается в силе, просто в механизме E2 неспаренный электрон оказывается в итоге на атоме углерода. И там пи-связь с одним электроном, можно сказать полуторная связь между углеродами.
Скорее всего вы правы ,потому что ничего другого я не смог придумать.
Ну смотрите, с катион радикалами мы всегда довольно оплошны в изображении структур. Посмотрите на то, с чего начинаем: нам дана вроде бы полноценная структура (некий спирт), потому что если убрать квадратные скобки, мы можем легко представить такую молекулу. Но все таки мы говорим, что это катион радикал, а значит какая-то из связей должна быть неполноценной (или у кислорода должно не хватать электронных пар).
Тоже самое применяется и к структуре алкена. Что-то в нем должно быть неполноценным: это может быть половинчатая двойная связь. А может быть какой-нибудь \cdot CH_3^+ фрагмент. Логично предположить, что скорее всего электрона будет не хватать в наиболее слабой связи: пи связи. Но мало ли че там происходит при ионизации молекул, и мы же структуру не изучаем (мы не можем поймать катион радикал и положить его в пробирку), поэтому мы просто говорим: вот этот фрагмент, который похож на полноценную молекулу, только еще катион радикал.