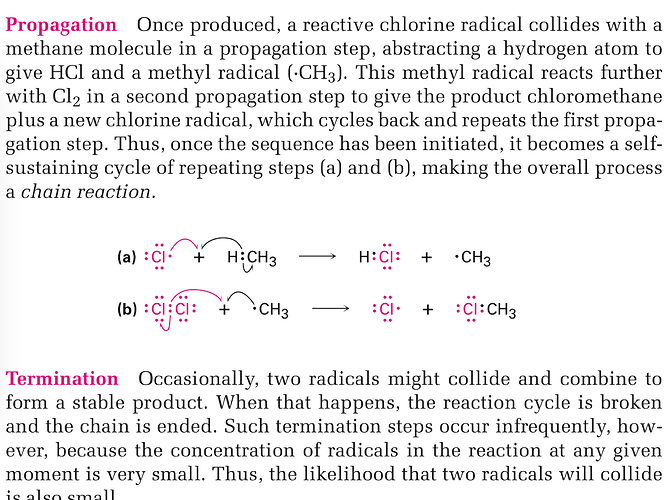
Почему метан реагирует именно с радикалом, а не с молекулой, и почему радикал метил реагирует именно с молекулой хлора, а не его радикалом.
А какой будет механизм реакции метана с молекулой хлора? Что будет образовываться? Вы можете нарисовать стрелками как это будет выглядеть?
Может и с радикалом.
Это элементарные реакции, значит мы можем смело записывать закон действующих масс:
и
Иными словами, скорость реакции зависит от концентрации (давления) каждого из реагентов. Очевидно, что концентрация радикалов сильно меньше концентрации полноценных молекул, поэтому r_c \ll r_b. Это общий вывод: реакции, в которых участвует один радикал всегда быстрее тех, в которых участвует два.
А при реакции метана с молекулой хлора разве не может образоваться СН3Cl и HCl, и тогда даже второй этап не нужен.
Весь прикол в том, что это реакция как бы правильная, но она не является элементарной, и представляет собой реакцию в общем виде
Еще раз говорю, покажите механизм? Как будет протекать эта реакция? Для любой возможной реакции можно нарисовать механизм, который будет показывать движение электронов. Покажите как это будет происходить в предлагаемом вами случае
любая реакция может протекать либо по полярному механизму, либо по радикальному. Радикальный механизм хлорирования как раз представлен на схеме в учебнике. При этом, мы не можем в ходе одной стадии механизма сразу электроны водорода отдать хлору, сломать хлор и соединить с углеродом. Слишком много стрелок будет. Если вы попробуете нарисовать то, что вы предлагаете в одну стадию – вы поймете о чем я. В ходе одной элементарной реакции (стадии механизма) двигается только один или два электрона. И вот движение одного-двух электронов и показано на схеме.