почему в случае, например, ванадия, два протона уходят с одного лиганда, а в случае железа - с разных?
Какой интересный вопрос. А можно я отвечу встречным вопросом, чтобы намекнуть? Почему у углерода и кремния похожая история происходит? И как изменяются d-орбитали в 3d-ряду металлов? А от заряда?
а это как, они же неметаллы
больше электронов на них, и заряд ядра увеличивается, ближе к ядру за счет более сильного притяжения становятся? вы намекаете, что причина в том, что ванадий -жесткий катион, а железо - мягкий?
А что, электроны на орбиталях проинформированы, о том что люди решили, что это неметаллы, и как-то себя иначе сразу ведут?
Ну я всё-таки хотел чуть поглубже это объяснить, через орбитали и радиусы. Но вообще, если очень-очень грубо, то да. Железо если хорошенько электронов лишить, будет тоже двойные делать в \ce{FeO^2-_4}
то есть неметаллы тоже образуют координационные соединения с водой?
можете, пожалуйста, объяснить поглубже?
Речь о другом, чем отличаются химические связи в координационных соединениях и у неметаллов?
ну в координационных соединениях они что-то между ковалентными и ионными, а в неметаллах -ковалентные
Я бы не был так категоричен. Всё зависит от конкретных условий, и связи принципиально не отличаются.
Есть много причин, по которым двойные связи с кислородом оказываются более привлекательные для элементов, нежели одинарные. Некоторые объяснения дублируют друг-друга и просто являются взглядом с разных сторон на одно и то же явление. Но попробуем что-нибудь отследить.
Начнем с простого наблюдения, что подобные вещи мы уже видели при переходе из второго периода к третьему: углерод/кремний, азот/фосфор.
Кремниевая кислота и её соли принципиально не любит двойные связи и всегда либо в орто-форме либо в виде полимеров/циклов. В то время как угольная кислота, орто-форму в воде не образует в принципе, да и вообще с радостью бы оказалась в виде оксида, где аж две двойные связи.
Азотная кислота тоже орто-форму не особо любит, в отличие от фосфорной, у которой мета-фосфорная, по аналогии с кремнием, всегда либо циклическая либо полимерная. В чём же причина?
Ответов несколько:
- Геометрия и поляризация.
Фосфор и кремний легче поляризовать и они геометрически больше, своих аналогов из второго периода. Поэтому они могут позволить и предпочитают большее количество кислородов рядом с собой. В то время как углерод и азот, уже не могут легко поместить вокруг себя 4 кислорода. - Подход через орбитали.
p-орбитали третьего периода более диффузные, а это означает, что пи-связи с довольно маленьким и жестким кислородом уже не могут конкурировать по энергии с одинарными сигма-связями, которые менее чувствительны к дистанции между ядрами.
Стоит отметить, что два этих ответа, на самом деле один ответ, просто разными словами.
Но главное, что один фактор мы уже для себя отметили, для d-металлов подобное тоже должно работать, но есть нюансы, а именно, у d-металлов в комплексах, особенно в сильно заряженных, начинают участвовать d-орбитали в образовании связей. Если вы знакомы с ТКП, то должны уже знать, про лиганды сильного-слабого поля, про \pi-акцепторы, \pi-донорные лиганды и т.д.
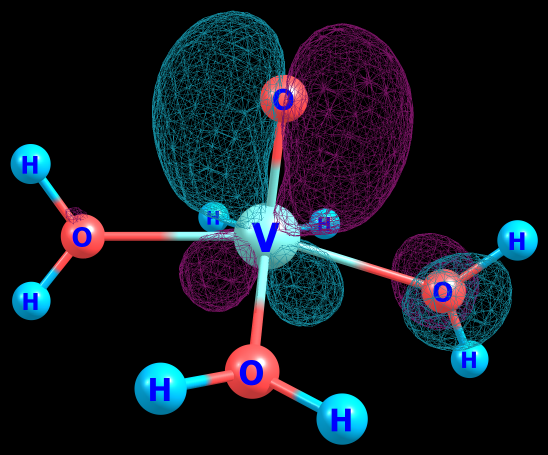
И если мы возьмем катион металла d-ряда, то мы можем повторить рассуждения выше, добавив немного специфики (помимо p-орбиталей, у нас еще есть d-орбитали на подпевке). Если мы сравним два катиона ванадия 3+ и 4+, то у более заряженного, во-первых d-орбитали будут менее диффузными и лежать ниже по энергии, во-вторых, останется всего один d-электрон. Это позволяет ему образовывать с кислородом более прочную и менее полярную \pi-связь (посмотрите на картинку). Если бы я взял титан +4, то его d-орбитали (и p-орбитали тоже) больше и выше, поэтому соли титанила плавают в воде в виде полиядерных комплексов с мостиковыми кислородами, т.к. \pi -связь с кислородом уже не такая прочная и она более полярная. В случае же с элементами второй половины d-ряда, так же нельзя забывать, что если на d-орбиталях остается много электронов, то сделать \pi-связь не выйдет, т.к. на разрыхляющих останутся электроны.
Все эти рассуждения находят своё отражение в теории кристаллического поля, и особенно хорошо ложатся на описание комплексов через метод молекулярных орбиталей. Полную диаграмму МО для комплекса ванадила я приводить не буду, т.к. всё самое важное я уже словами отметил.