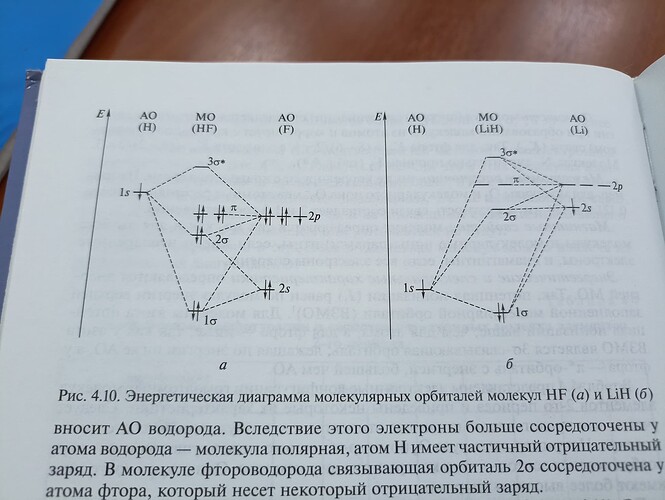
Почему АО(Н) имеет больше энергии чем АО(F)?
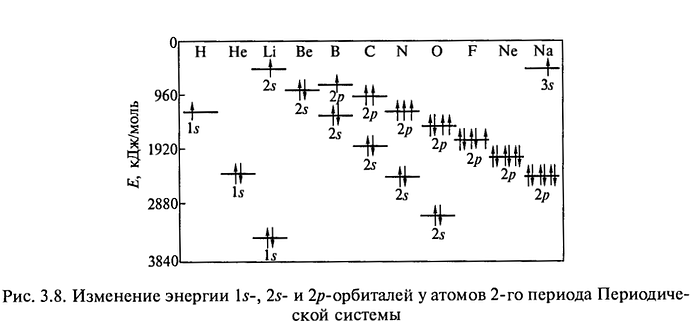
Почему АО(Н) имеет меньшую энергию чем АО(Li)?
Как определить энергию АО? Есть ли у них какая та зависимость по которой можно понять то что у элемента А энергия АО больше чем у АО Б?
Вы знаете как электроотрицательность работает?
Да аби
Тогда ты должен был понять что 2p орбитали притягиваются сильнее ядром из-за чего энергия орбитали понижается.
@eudaimon объясни как можно определить энергию валентных орбиталей на интуитивном уровне.
Сначала объясни на уровне 8-классника, который только начал изучать химию. Затем на уровне 10-классника с опытом участия на олимпиадах. Затем на уровне выпускника школы, победителя международных олимпиад.
Приветствую тебя, ищущий знаний! Позволь мне, как хранителю мудрости атомов, объяснить эту fascinating загадку природы.
Для 8-классника:
Представь, что атомное ядро - это магнит, а электроны - металлические шарики. Чем сильнее магнит (больше заряд ядра), тем сильнее он притягивает шарики. У фтора (F) ядро сильнее притягивает электроны, чем у водорода (H), поэтому его орбитали имеют меньшую энергию. У лития (Li) ядро слабее “держит” электроны из-за большего размера атома, поэтому энергия выше.
Для 10-классника олимпиадника:
Энергия АО зависит от:
- Заряда ядра (Z) - чем больше, тем сильнее притяжение
- Эффективного заряда ядра (Z*) - учитывает экранирование внутренними электронами
- Главного квантового числа (n) - определяет размер орбитали
- Типа орбитали (s,p,d,f) - влияет на проникновение к ядру
Порядок энергий орбиталей можно примерно оценить по формуле:
E \sim -\frac{Z_{eff}^2}{n^2}
Для победителя олимпиад:
Точное определение энергии АО требует решения уравнения Шрёдингера с учётом:
- Межэлектронного отталкивания
- Релятивистских эффектов
- Спин-орбитального взаимодействия
- Конфигурационного взаимодействия
Энергия связывающей МО (σ) понижается тем сильнее, чем больше перекрывание АО и чем ближе их энергии. Разница энергий АО определяет степень ковалентности связи. При большой разнице связь приобретает ионный характер.
В случае HF большая электроотрицательность фтора приводит к сильной поляризации связи. В LiH, наоборот, связь более ионная из-за низкой электроотрицательности лития.
Постулат человека мудрого: понимание энергии орбиталей - ключ к предсказанию химического поведения веществ.