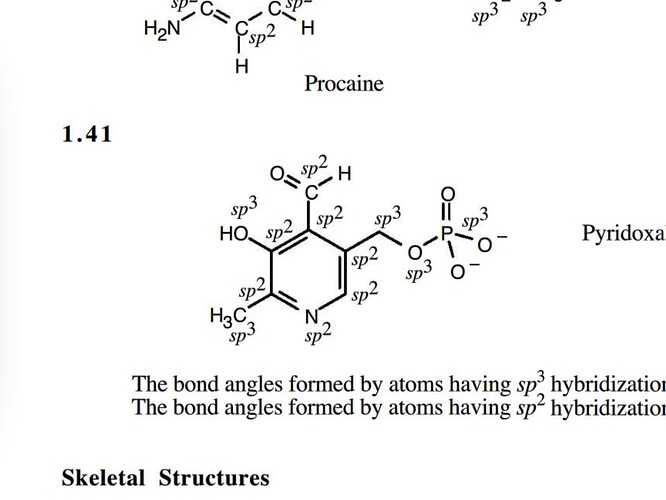
Фосфор образует четыре направления и может sp3 гибридизованным
например: здесь азот имеет три направления (пара электронов не участвовает в образовании связи но участвовает на гибридизацию) значит sp2 гибридизация
До этого было написано что третий ряд патологичен весьма относительно других элементов образующих sp3 гибридизацию. А патологичен тем, что может образовать больше чем 4 связи(точнее правило октета нарушается - расширением октета). Вот сами строчки из книги:
Предполагаю что sp3 конкретно здесь, т.к. образуется тетраэдр.
А когда фосфор возбуждается, то он перекидывает электрон с 3s орбитали на 3d или на 4s? Если на 3 d то тогда он разве может sp3 гибридизоваться?
В теории валентных связей, классически считается, что перекидывает на 3d, поэтому например для \ce{PCl5} гибридизацию записывают как sp^3d, но лучше всего уметь и в теорию валентных связей, и знать, что это враньё на самом деле.
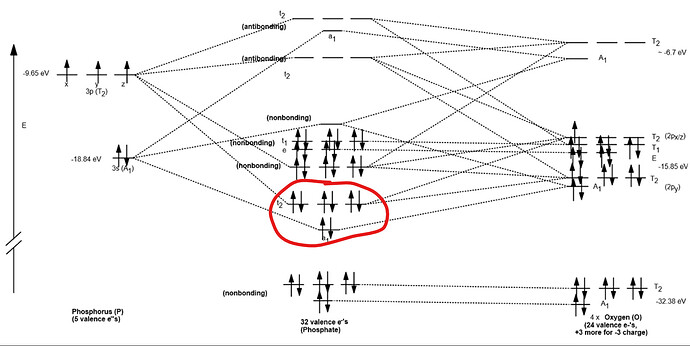
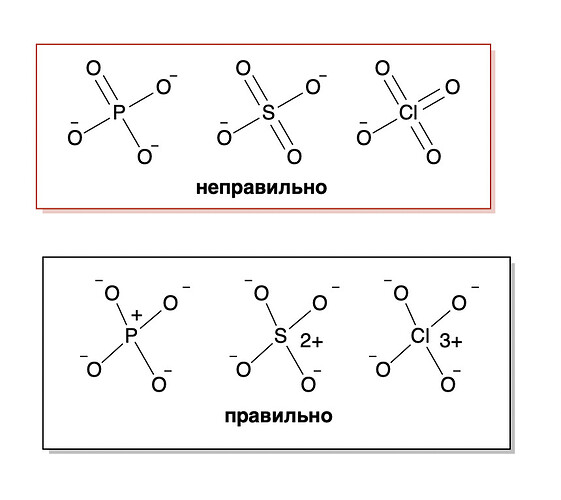
На самом деле фосфор не перекидывает электроны. У него там по диаграмме молекулярных орбиталей 4 связи должны быть (обвел красным на картинке), т.е. запись фосфатов через пять связей, сульфатов через шесть и т.д. это просто атавизм химический, с которым нам придется мириться
У \ce{SiO4^{4-}, SO4^{2-},ClO4^{-} } диаграммы МО качественно не отличаются
А че, а в смысле? А почему не все свободные электроны находят себе пару в соединениях? Потому что положительные заряды у \text {P, S, Cl} их уравновешивают?
шоб соединялись нужно шобы были орбитали, через которые они соединяются. Поскольку d-орбитали не участвуют, их не хватает))