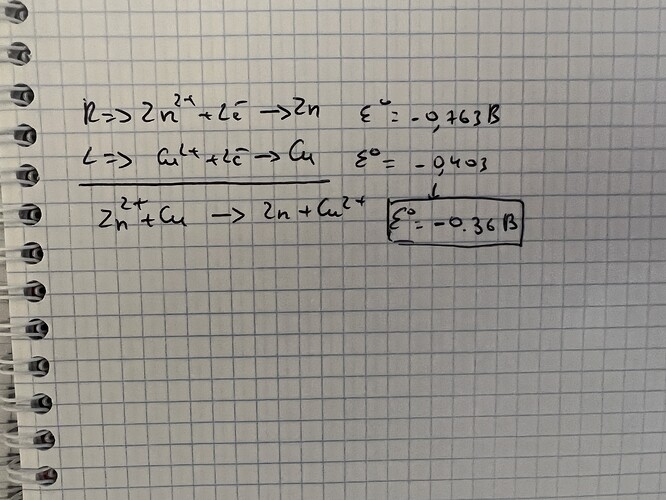Рассчитайте константу равновесия реакции ZnSO4 + Cd = CdSO4 + Zn
Помогите написать сам гальванический элемент, то есть вот такую вещь
![]()
Что будет справа, а что слева?
Какой будет стандартная ЭДС общая если:
стандартная ЭДС (Cu2+/Cu) = -0.403 В
стандартная ЭДС (Zn2+/Zn) = -0.763 В?
вообще в моей задаче просят найти константу равновесия
я понимаю как ее найти, но хотел бы уточнить, с отрицательным ЭДС получается k будет меньше 1?
Да так как экспонента будет с отрицательной степенью
- Анод пишут слева, катод справа
- Если у реакции отрицательный потенциал, то K<1
а кто из них катод, а кто анод?
Вроде справа катод слева анод
Я в том смысле, кадмий или цинк у меня катод?
На аноде происходит окисление, на катоде восстановление.
А в задаче требуют написать гальванический элемент, или просто найти константу равновесия?
И то, и то
Смотри, раз у тебя идет реакция Zn2+ + Cd0 => Zn0 + Cd2+ ( я не умею писать степени, поэтому только так) То ты должен написать две полуреакции. Первая как ты видишь это восстановление цинка. То есть он с окисленной формы переходит в восстановленную, что значит что он ПРИНИМАЕТ электроны, поэтому он будет анодом. А кадмий он отдает электроны, поэтому будет катодом. Как писали выше справа катод а слева анод, поэтому у тебя получится что цинк будет слева, а кадмий будет справа. Гальванический элемент тогда пишешь по схеме что сам же отправил на картинке.
Константу равновесия найти еще легче. Раз тебе выше уже нашли ЭДС, тебе только остается все подставить. Сначала можно найти дельту G, по формуле -nFE. F - число Фарадея, Е тебе уже нашли ( тот что 0.36 получился). Далее подставляешь под формулу константы и находишь его. Надеюсь объяснила понятно…
Все понял, спасибо всем за объяснение