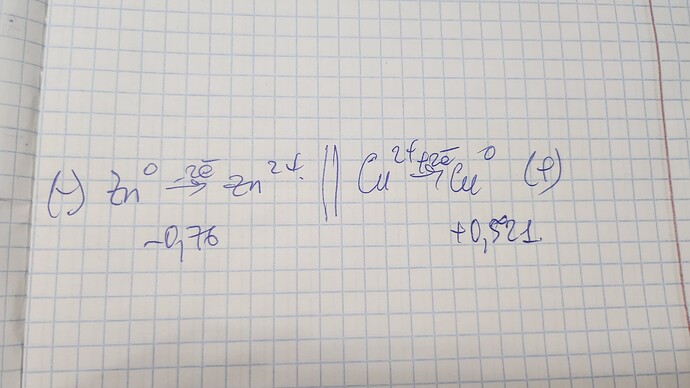Здравствуйте , напишите что вам конкретно не понятно а так же свои попытки решения
Извините,
Мне не понятно как эти значения поставить в уравнение Нернста
Я советую вам внимательно анализировать то что я написал
Надеюсь теперь вам понятно , думаю дальше сможете сами ( я предполагаю что у вас есть вопрос , почему я записал SHE на катод а хром на анод , все потому что если у одной реакций потенциал больше то она записывается на катод а если меньше то на анод )
продублируйте условие задачи текстом, в соответствие с правилами создания темы
Добро пожаловать на форум!
Если у вас возникают вопросы с простым решением, можете писать в канале “Решение Задач”.
Если у вас возникают сложные вопросы, которые надо решать и обсуждать/интересные в целом/весьма диспутные вопросы, можете спокойно задавать в виде темы ![]()
неправда.
Причина, почему хром на аноде – потому что в гальванической ячейке он указан слева. В символической форме гальванических ячеек слева указывается анод, справа катод
Ну это я тоже знал , просто заметил что в задачах в основном так (вроде бы) и вот решил написать а как оказалось неправда
Но в принципе его высказывания разве не верны? В этом случае да, он на аноде так как тут стандартный водородный электрод
Результат правильный, но от этого процесс, по которому он пришел к результату, не становится более корректным.
Его логика исходит из того, что у спонтанных реакций должна быть положительная ЭДС. Это верно, но это не мешает мне нарисовать гальваническую ячейку, которая спонтанно не работает. Может вся суть задачи в том, что при стандартных условиях она не работает, а если поменять какие-то условия ЭДС станет положительным?
E(ЭДС)=Е(катод)-Е(анод)
Да, здесь идет восстановление и хрома и водорода. Видимо да, но все здесь написано и схема нарисована правильно. Как уже говорила раннее, в правой части потенциал больше(положительнее) чем в левой части.
Не то чтобы создавать или менять какие-то условия, здесь если найти ЭДС то он будет положительным. Если бы потенциал восстановления хрома был больше чем у водорода, то в таком случае он бы записывался справа
Кажется я понял что вы имеете ввиду , буду учитывать в будущем спс
нет, если мы сделаем такую экспериментальную установку, где ток будет направлен таким образом, чтобы анод был на хроме, то анод будет на хроме
Нет, здесь идёт окисление одного элемента и восстановление другого, не смотря на то, что запись полуреакций в виде восстановления.
Конкретно в данной задаче Екатода больше Еанода. И во многих задачах так же, так как чаще задачи составляются про реакции идущие в прямом направлении. Но именно про ЭДС хватает задач и с отрицательным значением. Поэтому не следует усложнять и стоит выбирать катод и анод исходя из условия задачи, то есть схемы.
Однако, здесь в условии стоит оговорка, что это гальванический элемент (а не просто некая ОВР реакция), поэтому, Да, действительно стоит ожидать положительный ЭДС.
@LORD А точно ли Вы по факту сравнивали потенциал, а не стандартный потенциал. Вопрос чисто из любопытства, так как потенциал в записи на фото ещё на данном этапе вычислен не был.
Я сравнивал стандартный
Добрый день!
Попробуйте сделать следующий порядок действий:
- Напишите уравнения реакций на аноде и катоде, напишите итоговую реакцию
( начиная со следующих шагов можно пойти двумя способами, но я всегда иду через энергию Гиббса) - Посчитайте изменение энергии Гиббса ( dG) на аноде и катоде
- Так как энергия Гиббса- это аддитивная величина, то dG разных реакций можно складывать или отнимать, получая новые dG для других реакций. Определите как получить итоговую реакцию через реакции анода и катода ( умножить/ поделить/ сложить/ отнять) и дальше посчитайте dG для общей реакции
- Определите стандартное изменение потенциала через dG=-nFE
- Подставьте все в уравнение Нернста. Просто используйте формулу E=E°-RT/nF *lnQ, где Q это словно константа равновесия, но в любой момент времени. Напишите выражения для константы равновесия итоговой реакции ( вам подсказали с этим выше) и подставьте значения выданные в схеме гальванического элемента
Заранее извиняюсь если где то ошибся
так это, тут достаточно E_{\text{катод}}-E_{\text{анод}}, можно конечно перейти в \Delta G, но это как из Астаны в Боровое через Турцию лететь