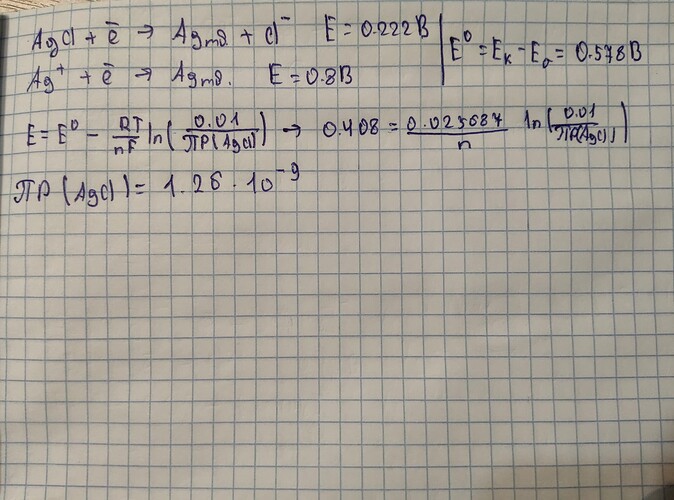Всем привет. Не могу понять один момент в первом пункте этой задачи. Я использовал уравнение Нернста,взяв ЭДС элемента как 0.170В,а стандартную как 0.8В-0.222В= 0.578В,Т=298К. В задаче было дано все кроме Е(Ag/AgCl). Вот мое решение:
Ответ в учебнике 1.79×10^-10. Не поняв что сделали в учебнике, я решил подставить ответ под формулу,и заметил то что они взяли значение 0.170В как ЭДС элемента и как E(Ag/AgCl). Можете объяснить почему они так решили? Кстати Е(Ag/AgCl) я посмотрел и в Гугле и в Ерёмине,в обеих источниках одинаковое значение.
Потому что тебе дан насыщенный раствор, где Q=K
Извините,можете обьяснить яснее,я знаю что такое Q но не понял что в итоге меняется если К=Q.
Правильный подход.
Вот тут и заключается твоя первая ошибка, а именно в том, что ты взял стандартный потенциал пары \ce{AgCl/Ag} как
Почему это ошибка? Объясню позже, поскольку имеется одна проблема, о которой пойдет речь ниже, и сперва надо разобраться с ней.
Она была не дана не просто так.
Твоя вторая ошибка заключается в том, что ты, скорее всего (я уверен где-то на 95%), неправильно записал уравнение Нернста для пары \ce{AgCl/Ag}.
Можешь эксплицитно показать, как ты её записывал?
Я думаю что идея задачи заключается в этом, хотя сам до конца не понял в чем она заключается, мои предположения: Тут стандартный потенциал у насыщенного раствора Agcl который не стоит путать с хлорсеребрянным электродом, у которого смысл работы заключается не в этом и там нет насыщенного раствора Agcl, и вот отсюда то и выходит Q=K потому что раствор находится в равновесии с твердой фазой, то есть является насыщенным, а это получается тот же самый с потенциал что у Ag+/Ag(стандартного) тут и получается что
E = \frac{RT}{nF} \ln Q
где Q у нас тот Q который ты написал ( но с корнем у ПР)
[ Коротко EстандAgcl=E(стан)Ag+/Ag0 ]
Однако тут есть момент который мне непонятен, мы определяли стандартный потенциал у Ag+/Ag0 с концентрацией серебра не относительно насыщенного раствора, тогда каким образом у насыщенного раствора Agcl потенциал равен этому потенциалу ?
По сути, у нас тут просто с Agcl идет обычная реакция как с Ag+ в Ag, потому что раствор с Agcl насыщенный, там плавают Ag+ и cl(-) а единственная реакция которая там идет на электроде это по сути тоже самая что и с Ag+/Ag ( То что я только что понял вроде как )
По ответу снизу я уже понял ошибку,спасибо вам
Спасибо,теперь мне ясно почему не была дана ЭДС (Ag/AgCl). А тот момент который вам непонятен похоже и не имеет отношение к данному пункту,т.к. после есть ещё некоторые пункты где нужно использовать данную информацию
Короче насколько я понял в обоих растворах просто идет одна и та же реакция с серебром, просто в разные стороны, с разными концентрациями, что и пригодиться нам для нахождения Ksp через E который нам дан, именно поэтому там одинаковые стандартные потенциалы, они оба измерены относительно одной и той же концентрации серебра ( аналогия с pH=0). Вроде как понятно
С этим не могу согласиться. На катоде протекает следующий процесс:
а на аноде протекает
Нельзя сказать, что в обоих растворах идет одна и та же реакция с серебром; они кардинально отличаются. Просто когда начинаешь считать, все технически сводится к тому, что ты описал.
Уравнение Нернста для пары \ce{AgCl/Ag} выглядит следующим образом:
Но что из себя представляет E_{\ce{AgCl/Ag}}^\circ? Вывод оставлю на вас (делается тривиально через энергию Гиббса), поэтому сразу к результату:
Теперь, если в лоб посчитать ЭДС, то получится следующее:
здесь [\ce{Ag+}]_{\text{right}} – текущая концентрация ионов серебра в правой ячейке, а [\ce{Ag+}]_{\text{left}} – текущая концентрация ионов серебра в левой ячейке (она же равновесная концентрация ионов серебра с учетом равновесия с растворением хлорида серебра).
Отсюда и видно, что технически, все сводится к тому, что ты описал. Но тем не менее, на катоде и аноде протекают разные процессы.
Понимаю, я имел ввиду «формально» однако точного вывода не знал, спс
Ну типо я имел ввиду: Кажется что идет так, на самом деле не так, а на самом деле как я не знаю