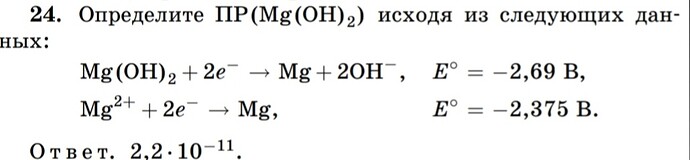Определите ПР(Mg(OH)2
) исходя из следующих дан-
ных:
Mg(OH)2 + 2e
− → Mg + 2OH−, E
◦ = −2,69 В,
Mg2+ + 2e
− → Mg, E
◦ = −2,375 В.
О т в е т. 2,2 · 10−11
.
Я нашел ЭДС реакции пр mgoh2 E= -0.63B. а ПР это 4х^3, только я не знаю что под х здесь поставить, можете помочь
Соединив две реакций в единое ты увидишь что mg у тебя стерся и остались только ионы и константа равновесия реакций это и будет Ksp то есть произведение растворимости а затем я бы на твоем месте применил -RTlnK=-nfE то есть тебе нужно найти энергию гиббса через эдс а затем использовать dG=-RTlnK где K это и есть ПР ( Решение:)
да вышло,спасибо, а можете подсказать как понимать сколько электроннов проходит в реакциях типо n
Ну смотри тут в обоих реакциях по 2 электрона передается то есть n=2 в реакциях посложнее типо с ванадием вольфрамом где в конечной реакций остается электроны к примеру 4e то n=4
большое спасибо
Можно в принципе тоже самое сделать, но гораздо быстрее. Записываем уравнение Нернста для пары \ce{Mg^{2+}/Mg}, а потом учитываем образование осадка (выражаем концентрацию ионов магния через константу и концентрацию гидроксид ионов). В таком случае E_{\ce{Mg^{2+}/Mg}} = E_{\ce{Mg(OH)2/Mg}} (почему?).
Отсюда можно заметить, что E_{\ce{Mg(OH)2/Mg}}^0 = E^0_{\ce{Mg^{2+}/Mg}} + \frac{RT}{2F}\ln K_{sp}, значит