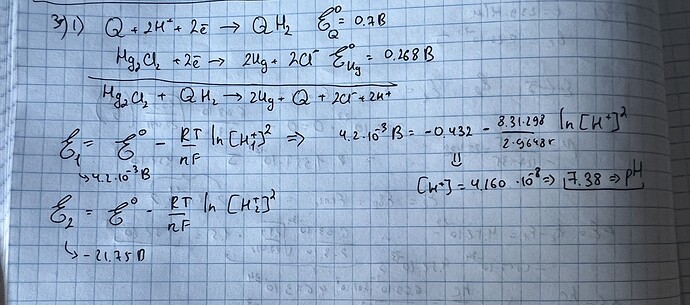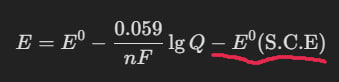Для начала посмотрим на ячейку. Обычно слево находится анод, а справо катод, на них проходят окисление и восстановление, соответственно.
Напишем уравнения полуреакций восстановления для обоих электродов:
\ce{Q + 2H+ + 2e- -> QH2}
\ce{Hg2Cl2 + 2e- -> 2Hg + 2Cl-}
А реакцию в общем виде можно записать как:
\ce{Hg2Cl2 + QH2 -> 2Hg + Q + 2Cl- + 2H+}
Второй электрод называется каломельным. Его обычно используют как сравнительный, а в первом, если я не ошибаюсь, под Q имеется в виду хинон. Уже написав полуреакции можно заметить, что потенциал будет зависить от концентрации водорода(т.e. от pH), потому что водород участвует в одной из них. Это можно расписать через уравнение Нернста.
E = E^0 - \frac{RT}{nF} \ln Q= E^0 - \frac{RT}{2F}\ln[\ce{H+}]^2
Как правило, если информации про концентрации других реагентов нет, то подразумевают стандартные электроды, поэтому остальные реагенты я не записал. Однако, чтобы решить задачу нужны справочные данные, а именно стандартные потенциалы восстановления. Загуглив находим, что для хинина он равен 0.7, а для ртути 0.268 . Дальше идет чисто подставление и решение уравнения.
Небольшой tip, чтобы проверить ответ: Чем больше потенциал, тем сильнее окислительные свойства вещества. По стандартным значениям видно, что хинон окислитель сильнее, чем ртуть, тем не менее, значение разница потенциалов между ними близка к нулю. Значит либо окислительную силу ртути повысили, либо уменьшили ее для хинона. В задаче возможен только второй вариант, поэтому концентрация иона водорода должна быть намного меньше единицы, что и видно из ответа.