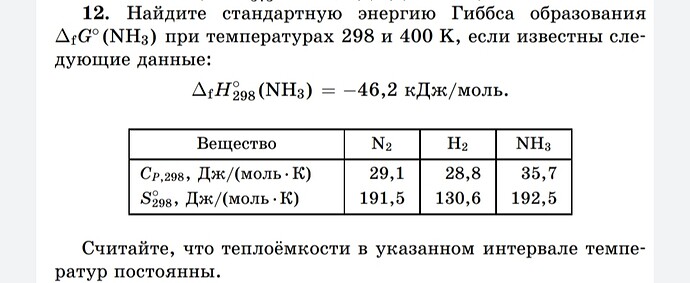
Можете помочь? Я так понимаю, нам дали теплоёмкости чтобы найти ∆S через формулу
(∆S = Cln(T2/T1))
Верно подмечено. Также, не стоит забывать про зависимость энтальпии от температуры
\Delta_{f}H_{T}(\ce{NH3}) = \Delta_{f}H_{298}^{0}(\ce{NH3}) + \Delta_{f}C_{p}(\ce{NH3}) \cdot (T - 298)
Выводится она из \frac{dH}{dT} = C_{p}, с помощью интегрирования (в приближении, что теплоемкость не зависит от температуры, что и сказано в условии)
Тебе надо всего лишь найти изменения энтальпии и энтропии образования аммиака при двух температурах, и в конце найти энергию Гиббса через известную формулу (\Delta G = \Delta H - T \Delta S)
6 лайков
Понял, спасибо. Но только у меня ответ на 0.06кДж меньше чем на ответе, немного сомневаюсь в своем решении:
Как думаете, всё норм?
похоже на правду.
Может быть из-за промежуточных округлений (после каждого подсчета логарифма)
1 лайк
Понял, спасибо