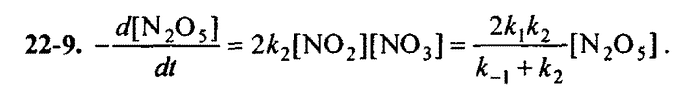Aslan
(Aslan)
1
22-9. Составьте кинетическое уравнение для скорости разложения оксида азота (V) по суммарному уравнению 2N_2O_5 (г) \rightarrow 4NO_2(г) + O_2(г) при следующем механизмe реакции:
N_2O_5 \rightarrow NO_2 + NO_3, (k_1)
NO_2+NO_3 \rightarrow N_2O_5, (k_{-1})
NO_2 +NO_3 \rightarrow NO_2 + O_2 + NO, (k_2)
NO+N_2O_5 \rightarrow 3NO_2, (k_3)
я не понял как выводить квазистационарное приближение для
[NO3]
(или там вообще квазиравновесное приближение?)
можете написать решение этой задачи
DiasTaraz
(𝙳𝚒𝚊𝚜 𝙺𝚘𝚛𝚜𝚑𝚢𝚋𝚎𝚔シ︎)
2
так как концентрация промежуточных веществ равна нулю, мы можем предположить, что скорость образования и израсходования для NO_3 равны:
\frac{d[NO_3]}{dt}=0=k_1[N_2O_5]-k_{-1}[NO_2][NO_3]-k_2[NO_2][NO_3]=k_1[N_2O_5]-[NO_2][NO_3](k_{-1}+k_2) \\\
[NO_2]NO_3]=\frac{k_1[N_2O_5]}{k_{-1}+k_2}
3 лайка
Aslan
(Aslan)
3
можете решить задачу я не смог решить
Он уже решил 99% всей задачи. Тебе осталось лишь только один шаг сделать, и ты придешь к ответу.
1 лайк