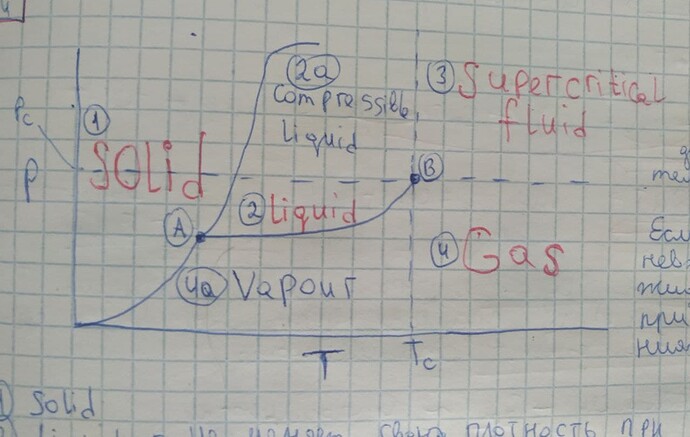
Достоверна ли эта диаграмма. Увидел у друга в тетради и начал спорить, что эта диаграмма неправильна. Есть ли отличие между газом и паром? Если есть, то какое? Какое отличие между сжимающейся жидкостью и обычной?
Да
Принципиально – нет. Так же как и между сжимаемой жидкостью и обычной.
Разница между газом и паром в том, что газ – это агрегатное состояние, а пар – это одно из возможных состояний газа. Т.е. любой пар – это газ, но не наоборот. Определение пара довольно наглядно представлено на этой фазовой диаграмме: пар – это вещество в газообразной фазе, которое при данной температуре и при определенном давлении может перейти в жидкую фазу. Вещества с T>T_C очевидно ни при каких давлениях не перейдут в жидкую фазу.
С сжимаемой жидкостью уверен меньше, но кажется идея та же – обрати внимание на поведение линии твердое-жидкое: она загибается сверху. Т.е. появляется такое давление, при котором жидкость может перейти в твердое вещество.
Я бы сказал, что эти различия значимы только для узкого круга людей. На практике, я не встречал разделения газа и пара на фазовых диаграммах ни на одной олимпиаде. И, надо отметить, даже в эткинсе его вроде бы нет.
Мдаа… спор я проиграл, но большое спасибо за ответ. Теперь буду знать)
Всякая жидкость вполне себе сжимаема) для такой характеристики есть изотермическая
и адиабатическая
сжимаемости (индексы T и S говорят о постоянных температуре и энтропии соответственно).
Согласен, но могу от себя добавить, что иногда под паром понимается то газообразное состояние вещества, которое на данный момент находится в равновесии с его жидкой фазой.
Есть хороший шанс, что твой друг срисовал диаграмму из википедии. Не знаю, насколько это честно в таком случае)
Это хороший жизненный урок: не спорь с людьми, когда не понимаешь основания для их уверенности в собственной правоте.
По хорошему он сам должен был объяснить тебе в чем разница между паром и газом) Иначе толку от нарисованной диаграммы ![]()
Если говорить о веществе, чья сжимаемость довольно велика, то таким свойством обладает вещество, состояние которого пребывает в критической точке. Взглянем на семейство изотерм на PV-диаграмме для модели реального газа.
Прямая изобара FG является процессом фазового перехода между жидким и газообразным состояниями. Например, уравнение Ван-дер-Ваальса математически описывает это как кубическое уравнение относительно объёма V. Когда вещество переходит в сверхкритическое состояние, границы между жидким и газообразным состояниями стираются, и изобара FG вырождается в точку перегиба K. В этой точке:
А из формулы для сжимаемости вещества:
Следует то, что \beta_T = \infty. В принципе, этот вывод происходит для любого процесса при фазовом переходе (однако его смысл попросту теряется :D), но случай с критическим состоянием имеет наглядный эффект, которым пользуются для демонстрации: если налить вещество в ампулу и привести в критическое состояние, то снизу ампулы оно должно сильно уплотняться под действием собственного веса.