Одинь моль фтороуглерода расширяется обратимо и адиабатически вдвое по объему , при этом температура падает от 298.15 до 248.44 К. Чему равно значение Сv?
Помогите , пожалуйста!
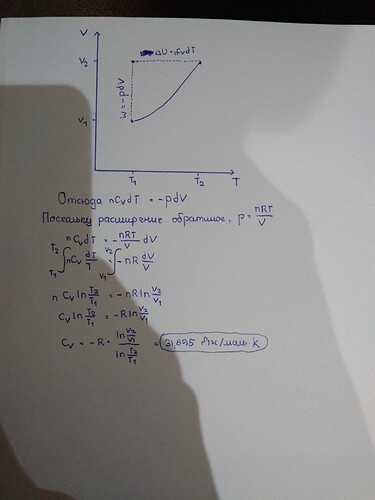
Здесь я постарался вывести формулу для расчета. Кратко поясню, что к чему.
Адиабатический процесс можно разбить на две части, как я и сделал на графике. В первом случае будет просто расширение при постоянной температуре, а во втором случае работы не будет. В итоге имеем W(adiabatic) = -pdV + 0 = -pdV. С работой разобрались.
Перейдем к внутренней энергии. Поскольку в первом случае температура постоянная, dU = 0. Во втором случае объем постоянный, и поэтому Q = CdT можно заменить dU = CvdT. В итоге имеем dU(adiabatic) = 0 + CvdT = CvdT.
Поскольку процесс у нас адиабатический, теплообмена не будет (Q=0). Из первого закона термодинамики следует, что в этом случае dU = W. Вот поэтому я на картинке приравнял их друг к другу, выразил давление через уравнение Менделеева-Клапейрона , и в конце проинтегрировал для двух температур и объемов.
Кстати, отсюда и можно вывести уравнение адиабаты. Поскольку Cp - Cv = R , Cv/R будет равно фактически Cv/(Cp-Cv). После небольших фокусов с возведением в степень (например 2ln(a) = ln(a²)) , получится знакомое всем уравнение адиабаты (правда там надо с помощью pV=nRT с температурой поколдовать, что и сделал Санжар)
Мне кажется у тебя график неправильный
А , да, пардон ))) Перепутал температуры. Там на самом деле будет зеркальный график. И наклон круче должен быть. Но вывод все равно останется тем же
но есть разница в формулах или там чт другое между расширение/сжатие ОБРАТИМОГО И НЕОБРАТИМОГО процесса. Просто я еще полностью не могу понять термодинамику…
Расширение/сжатие можно считать обратимым, когда давление в окружающей среде и в системе равны друг другу. Отсюда думаю понятно, что ооочень ничтожное изменение давления в системе или в окружающей среде может привести к расширению или сжатию. Другими словами, в обратимом расширении имеет место быть механическое равновесие.
А в случае необратимого расширения ты не можешь применять всякие формулы наподобие pV = nRT , потому что на самом деле в уравнении для расчета работы W = -pdV , давление представляет собой лишь внешнее давление. И в необратимом процессе внешнее давление не равно внутреннему давлению, от чего и называется сие процесс “необратимым”.
Немного погнал. pV = NRT это функция состояния, она не зависит от процессов. Она лишь зависит от начального и конечного состояния.
В вопросе обратимых и необратимых процессов важно понимать, что разница между ними заключается в энтропии. Необратимые процессы это те, в которых энтропия увеличивается. Обратимые процессы - те, в которых энтропия не изменяется.
Касательно формул: W = -p\ d V. Если процесс необратимый и происходит против внешнего давления p_{ext}, W= -p_{ext}\ \Delta V. Если процесс обратимый, это значит, что внешнее давление в каждый момент времени должно быть равно внутреннему (потому что при обратимом процессе, система может пойти в обе стороны). И тогда мы выражаем p через V с помощью уравнения состояния газа (будь то оно идеальное или любое другое) и уже интегрируем.
Концептуальное чтиво (из Daniel Schroeder, Intro to Thermal Physics)
спасибо!
Плюс к этому уравнение адиабаты pV^γ=const не работает для необратимых процессов. В идеале, процесс без теплообмена должен быть квазистатическим, а необратимые процессы таковыми не являются
Вот в чем преимущество присутствия всех предметов в одном месте!