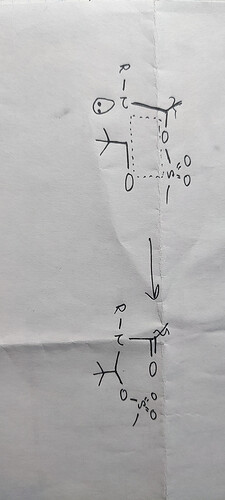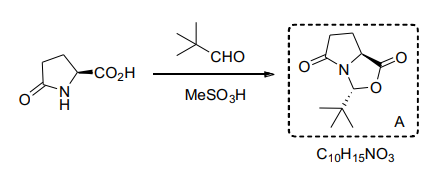
Я не совсем понимаю почему здесь после формирования эстера конфигурация R. В решениях написано что за неправильную стереохимию снимаются баллы. Объясните плиз
1 тур (Задачи)1 тур (Задачи)1 тур (Тапсырмалар)1 тур (Тапсырмалар)1 тур (Решения)1 тур (Решения)2 тур (Задачи)2 тур (Задачи)2 тур (Тапсырмалар)2 тур (Тапсырмалар)2 тур (Решения)2 тур (Решения)
Это обсуждение публикации https://olympiads.bc-pf.org/chemistry/national/2022/11

Я не совсем понимаю почему здесь после формирования эстера конфигурация R. В решениях написано что за неправильную стереохимию снимаются баллы. Объясните плиз
Я точно не уверен, но скорее всего все дело в том , что образуется новый хиральный центр при атаке азота по альдегиду и т.к данное бициклическое соединение будут в форме “ноутбук”, то tBu выгоднее находится на внешней ее стороне. Это можно представить как будто левый цикл это плоскость клавиатуры, а правый смотрит на нас(монитор), поэтому каркас молекулы примерно такой:
И как видно отсюда если бы tBu смотрел на нас, то он бы создавал большое затруднение, ведь он бы был на одной стороне с циклом. В случае если он смотрит от нас, то такого нет и затруднения меньше
P.S но я не особо уверен, по моему данное объяснение работает 100% когда цикл уже сформировался и добавляют в него заместители
В 33 главе Клейдена есть параграф Aldol reactions can be stereoselective. Там показывают как надо рисовать transition state для таких реакций. Стереоселективность исходит из них.
Спасибо за ответ! В твоём объяснении ты сказал что соединение выглядит как ноутбук, но я думаю что это не совсем правда потому что к азоту присоединены только 3 группы и его пара делокализована. Я вроде как разобрался - рассмотрел формирование эстера (лактона) через SN2 и понятно что если терт-бутил стоит в конфигурации которая приводит к S в конечном продукте, он сильно мешает карбоксильной группе атаковать углерод. Я тоже не 100% уверен но вроде как это makes sense
tBu будет в экваториальной позиции, да, но я не совсем понял каким образом у вас MeSO3 замещает карбоксильную группу и как она потом возвращается в изначальную структуру.
Здесь, насколько я понимаю, происходит нуклеофильное присоединение по карбонильной группе, после которой происходит внутримолекулярная этерификация
Просто в 33 главе часто показывали пример с эквивалентами енолов и енолятов и я подумал что возможно сначала O атакует серу что бы создать эквивалент енола, словно sillyl enol ether а затем уже происходит альдольная конденсация в ходе которой получается кислород и он “перенимает” SO2Me группу. Затем уже проходит внутримолекулярная этерификация
Я сам второй раз на те же грабли наступил. Обновил сообщение. Если внимательно посмотреть, связь с tBuCHO образуется не из альфа положения к любой из карбонильных связей, поэтому образование енола тут ничему не поможет.
я вот думал может быть попробовать Felkin Anh, но тут проблема в том, что 3 метилки попросту будут сзади
Felkin*
прошло два года с той респы, а я все еще не понимаю как амидный азот может атаковать кого-то
upd:Я сейчас расплачусь. Кажется там нет делокализации, ну типо как тут. Я полтора года не мог понять…
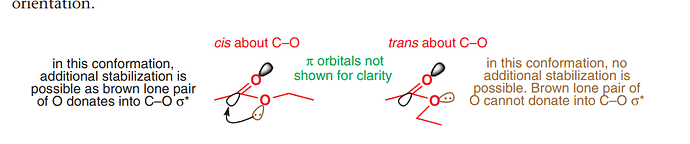
на картинке вроде как говорится именно про additional stabilization из-за взаимодействия sp2 орбиталей, и этим объясняется почему конформация слева более стабильная чем конформация справа. То есть conjugation есть и там и там, так же как и в лактаме из задачи.
так нет. В случае лактама или амида циклического как раз таки будет второй случай где не будет возможно перекрывание и стабилизация
Да, в лактаме не будет дополнительной стабилизации за счет sp2 орбиталей из-за его locked конформации, но conjugation и стабилизация за счет p орбиталей все еще присутствует, то есть пара делокализована.
Да и вообще насколько я понял в лактаме стабилизации за счет sp2 быть не может потому что на второй паре азота есть протон.
а да. Я как то не совсем правильно понял этот параграф, а так хотелось придумать причину(
Да, я тоже не совсем понимаю почему азот нуклеофильный здесь. Может быть если амид депротонировать (у амида pKa 17), то sp2 пара атакует карбонил, но условия вроде как кислотные…
У меня когда я эту олимпиаду писал было точно также… По-моему, на Аске была тема с фидбэком задач респы, где я негодовал этой реакцией лол