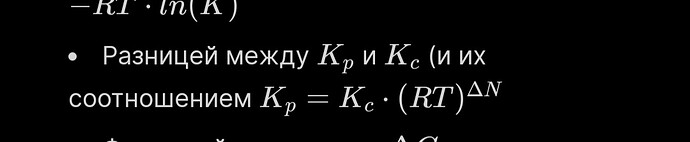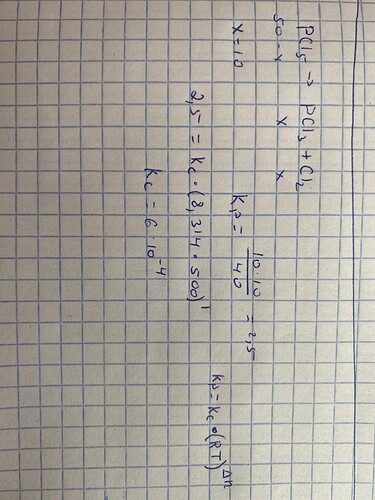Tofsu
16.Декабрь.2022 07:20:03
1
Добрый день! Не могли бы объяснить эту задачу?
Что-то не получается
2 лайка
Shakir
16.Декабрь.2022 08:15:56
2
Я думаю что ты забыл кПа в бары перевести.
2 лайка
Tofsu
16.Декабрь.2022 08:20:11
3
Есть такое, но правильный ответ- А вариант.
Shakir
16.Декабрь.2022 08:22:55
5
Блин там Кс, тогда просто найди n/V через pV=nRT
1 лайк
DiNih.MiKao
16.Декабрь.2022 08:23:24
6
Bakhytzhan Nurkhanov:
У тебя это KpK_pKp
А в чем разница между K_c и K_p ?
2 лайка
elprimo
16.Декабрь.2022 08:26:27
9
Kp это простт константа для газов по давлениям, а Кс это по концентрациям(для газов надо переводить)
6 лайков
Sanjaster
16.Декабрь.2022 08:29:00
11
Что под \Delta N ? И ещё если он равен 1, то K_p должно быть не 0.025 а 2.5
3 лайка
elprimo
16.Декабрь.2022 08:29:34
12
разница между суммой коэфов газов слева и справа
3 лайка
Sanjaster
16.Декабрь.2022 08:31:12
13
Зачем вообще Кс нужен. Все же и с K_p норм
4 лайка
Tofsu
16.Декабрь.2022 08:34:06
14
Всем спасибо! Но мне еще интересен вывод формулы. Почему именно так?
elprimo
16.Декабрь.2022 08:46:37
15
эткинс, глава про равновесие, там вроде вывод есть
3 лайка
Anton
16.Декабрь.2022 12:29:49
16
Калиакбар Санжар:
Зачем вообще Кс нужен
А вы никогда в жизни не записывали константу равновесия через концентрации? Всегда только с давлениями работали?
Sanjaster
16.Декабрь.2022 15:35:47
17
В газовой фазе концентрация все также равна моль на литр? Или это только для жидкостей? Получается, чтобы перевести \frac{P_1}{P_2} \rightarrow \frac{C1}{C2} достаточно умножить на (RT)^\Delta N ? Наверное эту формулу вывели через интегрирование или типо того, но как же эта \Delta N оказалась в степени?
Madsoul
16.Декабрь.2022 15:42:53
18
Эту формулу вывели с помощью математики из средней школы.
\ce{aA + bB = cC + dD}
K_{p} = \frac{p_{C}^{c}p_{D}^{d}}{p_{A}^{a}p_{B}^{b}} = \frac{([\ce{C}]RT)^{c}([\ce{D}]RT)^{d}}{([\ce{A}]RT)^{a}([\ce{B}]RT)^{b}} = \ce{\frac{[C]^{c}[D]^{d}}{[A]^{a}[B]^{b}}} \cdot (RT)^{c+d-a-b} = K_{c} \cdot (RT)^{\Delta n}
На заметку:
p_{A} = \frac{n_{A}}{V} RT
5 лайков