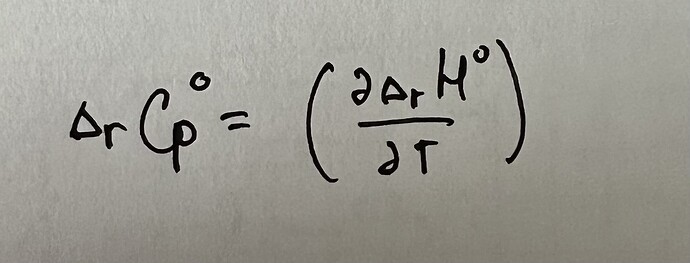Arthur7
01.Май.2024 11:41:23
1
Зависимость теплового эффекта реакции
CH_3OH_{(г)} + \frac{3}{2} O_2 = CO_2 +2H_2O_{(г)}
от температуры выражается уравнением
∆_rH^{o}_T (Дж ·моль^{−1}) = −684,7·10^{3} +36,77T −38,56·10^{−3}T^{2}+8,21 · 10^{−6}T^{3} +2,88 ·10^{5}/T.
Рассчитайте изменение теплоемкости Δ_rC_P для этой реакции при 500 К. ∆_rH^{o}_{500K} = -674,35 кДж * моль ^{-1}
Ответ:
∆_rC_{P(500К)} = 3,216 Дж*моль^{-1}*К^{-1}
1 лайк
LORD
01.Май.2024 11:44:24
2
Я кажется решил, скажи ответ пж
1 лайк
Arthur7
01.Май.2024 11:46:02
3
3,216 J * mole^{-1} * K^{-1}
1 лайк
LORD
01.Май.2024 11:47:54
4
А ты точно сюда правильно переписал уравнение ?
Arthur7
01.Май.2024 11:49:31
5
Поставил рисунок, думаю правильно
1 лайк
LORD
01.Май.2024 11:51:24
6
Попробуй это использовать
1 лайк
Arthur7
01.Май.2024 11:52:45
7
Да хотел, но , надо найти в двух температурах или 500К хватит для найти ∆_rC_P ?
LORD
01.Май.2024 11:53:18
8
Хватит думаю, одну же дали
Arthur7
01.Май.2024 11:54:01
9
Как использовать эту формулу, нет идей у меня, или интеграл нужен?
Alibi
01.Май.2024 11:57:24
12
Ты имеешь ввиду эту формулу?
\Delta_r H(T_2)=\Delta_r H(T_1)+\Delta_rC_p(T_2-T_1)
1 лайк
Arthur7
01.Май.2024 11:58:21
13
Типа да, и интегральный формулу тоже использовал
Alibi
01.Май.2024 11:59:19
15
А ты понимаешь как выводится эта формула?
Arthur7
01.Май.2024 12:00:18
16
Просто, не знаю, 505 К красиво выглядит)))
Arthur7
01.Май.2024 12:01:39
17
Интегральный или без интегральный, оба тоже выводиться из дифференциальный формы
LORD
01.Май.2024 12:02:21
18
ты таким образом чето маленькие границы поставил, тут вообще границы не дали, просто одну температуру 500К поэтому я говорю производить
Arthur7
01.Май.2024 12:05:08
20
Просто не знаю производные, или ты об этом:
\frac{ d∆_rH}{dT} = ∆_rC_P
d и \delta одинаковые величины?
1 лайк