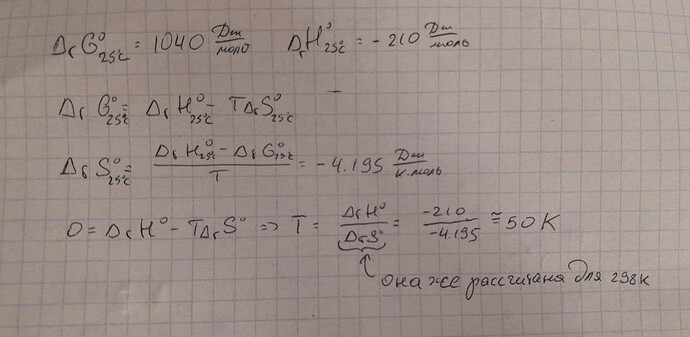Рассчитайте температуру, при которой две формы CaCO_3 — кальцит и арагонит — находятся в равновесии при давлении 1 атм. При 25^{o}C ∆_fG^{o} кальцита и арагонита равны −1128,79 и −1127,75 кДж/моль соответственно, а Δ_fH^{o} равны −1206,92 и −1207,13 кДж/моль соответственно. Считайте, что ΔC_P = 0.
Мне было вот такая идея:
P= const значит у нас будет формула, примерно так;
Как только давление постоянно, у нас энтропия будет равно:
И у нас уравнение 1 имеет вот такой вид:
После этого я интегрировал эту уравнение, имхо вот так:
H_m= const потому что P=const , и так после интегрирование, у меня получилось:
И я эту формулу использовал для решения задач в виде:
Нашел ∆G^{o}(25^{o}C) и ∆H:
После этого, я взял ∆G(T_2)=0 и поставил все данные:
И у меня получилось T_2=2,1K, на самом деле ответ 50К
Где у меня ошибка, скажите пж