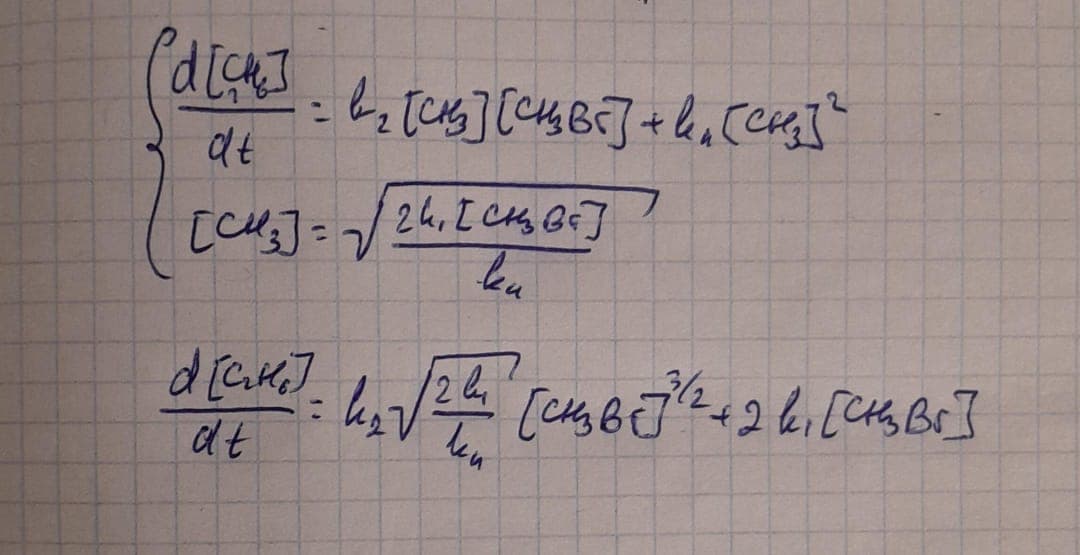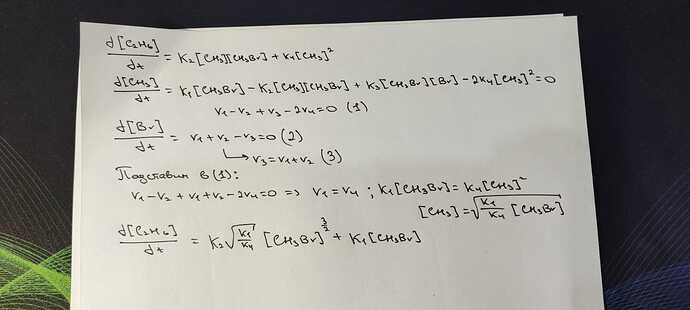Реакция разложения бромметана
У меня ответ не сошелся:
LORD
05.Март.2024 14:31:51
2
А что такого примечательного вы заметили в этой цепочке ? ( обратите внимание на реакций)
1 лайк
Alibi
05.Март.2024 15:13:24
4
Можешь расписать как ты получил выражение для \ce{[CH3]} ?
2 лайка
Ablay
05.Март.2024 15:19:48
5
Они кжс 2 включают в константу k1 сразу же
1 лайк
У тебя в 4той реакции 2CH3, когда пишем d[CH3]/dt =… -2K4[CH3]^2, как Абильмансур сказал. А дальше [CH3] у тебя должно правильно выйти
Otoro
05.Март.2024 15:37:02
7
Нене, константы обычные.
[IMG_20211202_102602]
Но могу решить задачу, так как тут 2 интермедиата . Выразил формулу для концентрации для каждого интермедиата
[Br]=\frac{k_1\ce{[CH3Br]}+k_2\ce{[CH3]}\ce{[CH3Br]}}{k_3\ce{[CH3Br]}}
\ce{[CH3]}=\frac{k_1\ce{[CH3Br]}+k_3\ce{[CH3Br][Br]}}{k_2\ce{[CH3Br]}+2k_4}
Правильно ли я выразил формулы?
И подставляя на выражение скорости образования этана не могу сократить из уравнение интермедиаты
За всю истортю теормата лишь была 1 задача с такой включенной двойкой - задача которую Антон решал
1 лайк
Ablay
05.Март.2024 15:42:41
8
Да, чет я не сделав вывод должным образом на бумаге сказал, сорри. Оказывается там просто двойки сокращаются
7 лайков