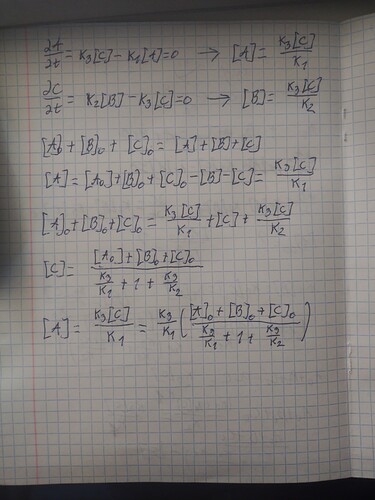21-31
В газовой фазе при 60 градусов реакция протекает по следующему механизму :
вот тут я сначала интегрировал, вынося за интеграл давление парцильное других веществ, потом посчитал все через мат баланс во сколько раз уменьшилось давление А и все вышло правильно включая 2 пункт. Потом мне говорят то что выносить за интеграл эти давления нельзя, я говорю: Это конечные, мне сказали нет, пытаюсь решить не вынося через мат баланс, не выходит. Думаю решение не вынося за интеграл давление было правильным, но почему ??? Потом заметил: ПОСЛЕ ОКОНЧАНИЯ РЕАКЦИЙ и кажется это конечные давления, поэтому выносить можно, так ли это ?
На 3ей строчке ты не можежь выводить за интегралл давление С так как оно зависит от времени и не являеться константой. Правильный метод решения по моему мнению являеться то что бы приравнять все dx/dt нулю и затем найти через матт. баланс и вышедшие уравнения окончательное давление А. Почему берем все dx/dt нулю? а потому что в условии сказано
об окончание реакции а значит изменение давления всех веществ должно равняться нулю. При надобности могу скинуть решение.
Можешь скинуть пж, хочется чекнуть
Мне интересно а как оно равно 0 если dx/dt это изменение ? А стоп, окончание это вот при равновесии, при равновесии как я ниже написал t стремится к бесконечности и то что 1-e^(-kn*t)у меня e^-kntзанулилилось и просто стало 1 и я получил точно такие же уравнения как у тебя, поэтому у меня вышло. Однако правильно ли брать dx/dt=0 если это изменение, скорость, то есть скорость при равновесии не будет равна 0, или правильней взять интеграл а потом устремить время к бесконечности ?
Просто приравнивая dx/dt к нулю мы устанавливаем условие «квазистационарности, то есть скорость расходования равна скорости образования, однако тут это не так, но возможно в такой цикличной схеме K=rn/rn+1 однако я не уверен в этом. То есть тут у нас при его установлении получается условие того что у нас все и А и В и С долго в системе не держатся, однако это не так. Как быть тогда ?
Иными словами вопрос : Реакция окончилась при равновесии, означает ли равновесие конкретно в этом случае, где нет обратимых реакции : r1=r2=r3 ? Мне почему то кажется что нет, так как нет никакого термодинамического контрол
А вынес я за интеграл, хз почему, мол при равновесии C=const
Скорее очередность таких операции зависит от сложностей начального уравнения.
Да, как же иначе она может закончиться?
В данном случае да
Так мы предаём какое либо свойство (равновесное, полупрореагившое) и т.д С после интегрирывания, при подставление границ.
Кажется я понял почему, возьму на заметку что при такой системе равновесие вообще есть и тогда r1=r2=r3 так как это как A=B но с интермедиатом по середине, обратимость есть мол
Лол я все равно не понял почему при окончании реакции или же при равновесии у нас r1=r2=r3 капец что со мной не так
Вот что я еще подумал : Когда у нас реакция закончилась именно в моменте когда она уже не идет у нас, их концентрации тупо становятся стационарны так-как ну нет их изменения. До этого времени я думал так : Как dx/dt равно 0 если у нас есть изменение от начало до конца реакции, однако уяснил что надо было найти изменение в “моменте” а такого нет
Спс я благодаря тебе понял важную задачу