Почему валентность фосфора - 5?
Благодаря свободных d - орбиталей может переходить в возбуждённое состояние, в котором имеет 5 неспаренных электронов.
Стоит отметить, что фосфор может проявлять и другие валентности кроме 5 (например PH3 - валентность фосфора 3, или PF6(-) - валентность фосфора 6).
Причину можно рассмотреть более наглядно на этой картинке:

Атому фосфора сообщается определенная энергия, за счет которой происходит проскок электрона (простыми словами - скачок). Далее, какие то другие атомы могут делиться одним электроном, образуя химическую связь. По картинке видно, что таких связей может быть 5 (но это не максимум, т.к есть еще вакантные (свободные) d орбитали).
С одной стороны забавно: во всех учебниках(даже школьных) говорится о том, что азот не проявляет валентность равную 5, в то время как фосфор проявляет. Как и отметил @nonaem, у фосфора в отличие от азота имеются d-орбитали, которые по энергии позволяют электрону перескочить на d-орбиталь. Именно по этой причине фосфор может иметь валентность равную 5, а азот не может.
Думаю, вопрос не зря появился в разделе “Биохимия”, и наверное стоит привести пример конкретно из биохимии, и вопрос скорее задает биолог)) В качестве примера возьмем эту молекулу
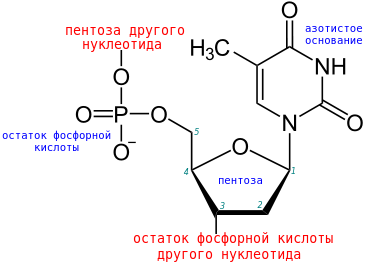
Суть в том, что валентность - это грубо говоря число связей, которое образует интересующий нас атом(в данном случае фосфор). По картинке отчетливо видно, что число связей 5, и соответственно валентность равна 5
Вообще говоря не всё так просто и там d-орбитали не участвуют
На самом деле вопрос поставлен слишком обобщенно, а ответ зависит от уровня твоих познаний в химии.
Например, если ты только начинаешь изучать химию, ответ будет таким: фосфор находится в 5 группе, значит у него 5 электронов на последнем уровне, а значит он может образовывать 5 связей, что и есть валентность. И больше вопросов нет.
Но, допустим, ты уже знаешь, что на s орбитали одно “окошечко”, а на p орбитали три. И т.е. вроде бы у фосфора всего 4 окошечка, в которые могут заходить электроны. Куда идет 5-ая пара?
И тут можно сказать, что у фосфора есть близкие по энергии и свободные d-орбитали. И на самом деле этот ответ можно увидеть во многих учебниках по химии. И он вполне справедлив на определенном уровне знаний.
Но на самом деле, квантовые вычисления показали что вклад d-орбиталей не велик. Тогда как же так? В чем же дело? А дело в том, что мы пытаемся мыслить в рамках традиционной “валентной” теории связи. А надо мыслить в рамках молекулярных орбиталей. И можно вполне спокойно построить МО для пятивалентного фосфора без участия d-орбиталей.
Чтиво на ночь: