Почему азот в аммиаке sp³, но связи фосфор-водород в фосфине образованы р орбиталями фосфора?
Первое что приходит в голову, так это то что азоту нужно приблизить (понизить) энергии своих орбиталей к орбиталям водорода для связывания. Однако, р орбитали фосфора ведь намного выше по энергии чем р орбитали азота… эьо получается что гибридизация ему намного нужнее… вероятно это и есть ответ, но я что-то упускаю
И тут вылезает еще одна идея, а может s и р орбитали Фосфора сильно различаются по энергии и потому гибридизация невозможна? Но этот вариант мне кажется очень притянутым за уши, ведь мы не говорили о гибридизации как о процессе который обязательно протекает в атоме. А значит и говорить про эффективность образования гибридных орбиталей будет неправильно…
2 лайка
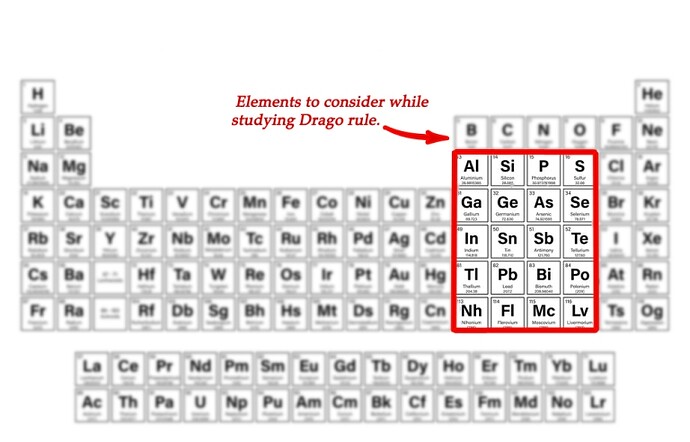
Да, здесь причина в очень большой разнице между энергиями орбиталей. А когда ещё такое наблюдается, можно прочитать в ‘правиле Драго’ и в описании ‘молекул Драго’.
4 лайка
А почему правило Драго вообще работает, то есть почему у этих элементов брльшая разница в энергии между s и р, хотя у Азота это не так?
1 лайк
![]() Clayden:
Clayden:
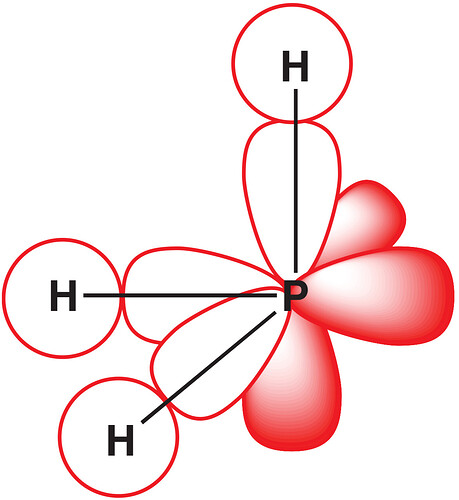
For some molecules, such as H2S and PH3, which have all bond angles equal to 90°, the bonding should be straightforward—the 3p orbitals (which are at 90°) on the central atom simply overlap with the 1s orbitals of the hydrogen atoms.
То есть экспериментом нашли 90°, и аа, тогда пи орбитали
4 лайка