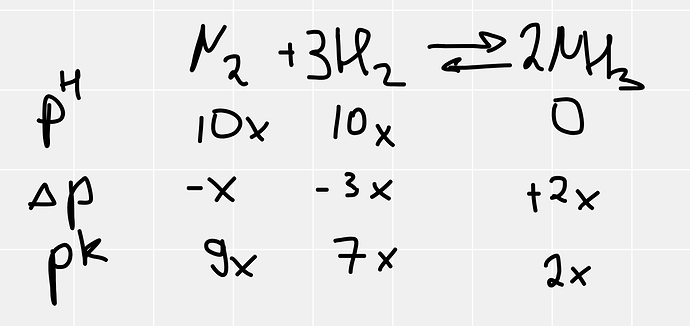В герметичном сосуде находится 1 моль азота и 1 моль водорода. После нагрева до некоторой
температуры, константа равновесия системы N2 + 3 H2 ⇄ 2 NH3 стала равняться 0,15. Рассчитайте
давление в сосуде в момент равновесия (в барах), если в результате реакции образовалось 0,2
моль аммиака. Ответ округлите до сотых.
В ответах к демоверсии получилось 1.67. Подскажите каким образом можно от молей перейти к парциальным давлениям? Распишите решение, пожалуйста ![]() заранее спасибо за ответ!
заранее спасибо за ответ!
Скорей всего в задаче подразумевается, что вы можете считать газы идеальными.
А, прошу прощения, впервые просто на сайте ![]()
![]()
![]() . Я расписала таблицу было прореагировало стало, равновесные количества вещества получила. Также Kp расписала, а дальше не очень идет. Я предположила, что количества вещества пропорциональны парциальным давлениям, одно из давлений за х обозначила, остальные выразила через отношение количеств веществ. Это все в константу подставила, но х, то есть парциальное давление аммиака в моем случае, вышел 8,0296 бар. Соответсвенно, если его с другими парциальными давлениями сложить 1.67 не выйдет(((( не подскажите как в такой ситуации на парциальные давления выходить?
. Я расписала таблицу было прореагировало стало, равновесные количества вещества получила. Также Kp расписала, а дальше не очень идет. Я предположила, что количества вещества пропорциональны парциальным давлениям, одно из давлений за х обозначила, остальные выразила через отношение количеств веществ. Это все в константу подставила, но х, то есть парциальное давление аммиака в моем случае, вышел 8,0296 бар. Соответсвенно, если его с другими парциальными давлениями сложить 1.67 не выйдет(((( не подскажите как в такой ситуации на парциальные давления выходить?
Я не понял способа вашего решения , но похоже понял суть задачи.
Попробуйте использовать закон Дальтона и следствия из неё:
pобщ=pO2+pN2+pNH3
Как каждое парциальное давлением соотносится с давлением общим?(Тоесть как можно парциальное давление газа выразить через общее давление)
Спойлер
Подсказка: соотношение молей одного газа к общему количеству молей газов зовется мольной долей , дальше сами)
Вашо сообщение говорит о том что вы уже знакомы с законом Дальтона, так что я уверен что вы сможете это решить, если непонятно что то ,можете задавать вопросы
Смотрите, у этих задач есть две большие разновидности, первая, это когда объем не меняется и постоянен, тогда действительно давления газов пропорциональны количествам.
Вторая разновидность, где постоянно внешнее давление, тогда задача становится чуть сложнее, но принцип решения не меняется, просто приходится мольные доли еще считать.
Мы решаем задачу, где постоянный объем. Поэтому ваш подход с давлениями, для которых мы считаем стехиометрию, рабочий. Скорее всего в этой стехиометрии вы и запутались.