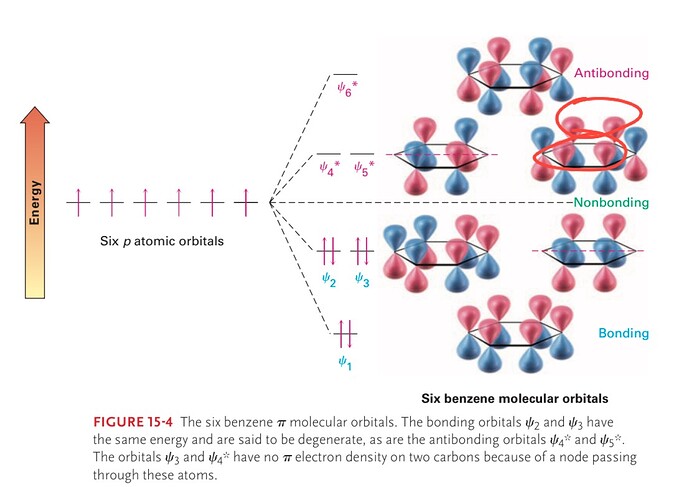
Можете объяснить как тут работает bonding и antibonding,я не понял как там происходит перекрывание.В моем понятии перекрывание это когда вот те одинакового цвета пи электроны могут взаимодействовать с другими такими же, теперь вопрос те красные пи электроны которых я показал ,почему они не перекрываются?
В общем случае, наличие конструктивного перекрывания между рассматриваемыми атомными орбиталями в МО может и не говорить о том, что данная МО является связывающей (исключением являются молекулы, которые образованы только из двух атомов).
Перекрываются не электроны, а атомные орбитали. И стоит характеризовать не цвет, а фазу орбиталей (стоит помнить, что цвета — это лишь конвенция для более легкого визуального восприятия).
Они перекрываются, просто проблема заключается в определении разрыхляющей молекулярной орбитали. Молекулярная орбиталь называется разрыхляющей, если ее энергия выше чем энергия первоначальных атомных орбиталей, из которых она образована[1]. As a rule of thumb, можно по отдельности посчитать кол-ва конструктивных и деструктивных перекрываний между АО, из которых образована рассматриваемая МО, а потом посмотреть, что преобладает. К примеру, в той МО, о которой сейчас идет речь, имеют место быть два конструктивных перекрывания, и четыре деструктивных перекрывания. Последнее преобладает, поэтому МО является разрыхляющей.
Но тут я немного сомневаюсь в строгости такого определения в общем случае. ↩︎
Судя по тому, как вы неверно используете термины, я бы посоветовал вам углубиться в теорию на более простых примерах, а не начинать сразу с бензола. Начните с двухатомных молекул, почитайте про электронную плотность, о том, как закон Кулона действует на электронную плотность и т.д.