Как я понимаю в p орбиталях может находиться по 2 электрона, которые мы обычно записываем как стрелка верх и вниз верно? И получается эти 2 шарика Синий и Красный это и есть они? Тогда почему S орбиталь выглядит так, будто на ней всего лишь 1 электрон, ведь он это просто 1 шарик.
2 вопрос: на 3 p орбиталях ведь по 2 шарика и к ним в придачу s орбиталь с 1 шариком, так почему при гибридизации s орбиталь куда-то девается а из 6 шариков от p орбиталей остаются только 4, как показано на рисунке.
3 вопрос, что это за An sp3 орбиталь, что находится в правом нижем углу, почему на нем один большой красный шарик и один маленький синий, типо почему так происходит и, что вообще происходит.
И последний вопрос: Что это за lobes типо в переводчике пишут, что Доли но, что ещё за доли, почему они не симметричны относительно ядра , дают направленность и позволяют образовать сильную связь.
нет обе стрелки должны быть направлены вверх по правиле наибольшего спина или Гунда.
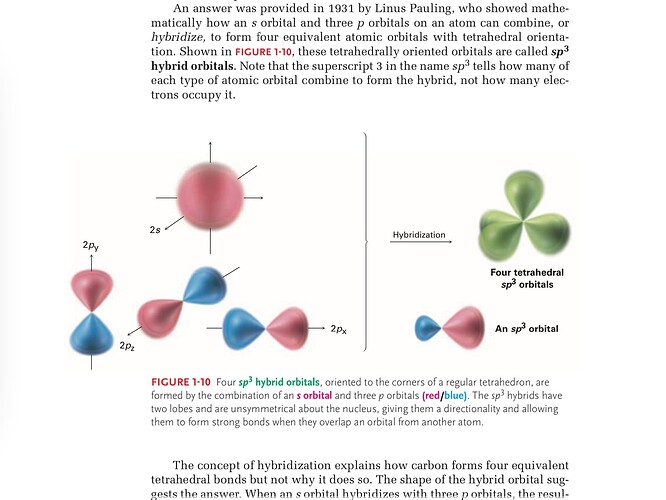
она и должна так выглядит так как в тетраэдрической форме (показана зеленым цветом) углерод предельный (алкан) то есть он в возбужденным состояние и один электрон из 2s уровня переходит в 2p и получается одна s и три p уровня о чем и говорит гибридизация (sp3)
не совсем ведь у углерода 6 электронов вообще а на 2p уровне всего 3 в возбужденном состояние 3p + 1s = 4 как показано на рисунке
не совсем уверен но вроде где-то из них положительный а где-то отрицательный заряд или что-то того
в буквальном смысле переводится как доли
именно для этого и нужна гибридизация. Как видишь в тетраэдре все связи равны но по сути 1s и 3p электрона должны были давать не равномерные связи но из-за гибридизаций они связываются или типа того и дают 4 идентичной или почти идентичной связи.
ава
вроде работает как на картинке одна s и три p соединяются в sp3 образовалось как раз 4 для 4 связей углерода
Давай попробую ответить)
Дело в том, что цветом лишь показаны знаки некой “волновой функции”, с которой тебе, если ещё нет, то придется познакомиться в будущем. Сразу скажу, что lobes можно перевести как “лопасть”. И в целом p орбиталь, т.е. синяя и красная лопасть, являются одной целой орбиталью. 2 электрона, которые располагаются на такой орбитали, могут занимать любое место в пределах синей и красной “лопасти”. Т.е. неверно предполагать, что один электрон - на синей, в второй - на красной. Они оба могут располагаться в любой и лопастей.
Каждая орбиталь атома имеет свой энергетический уровень, который определяется энергией одного электрона на данной орбитали. У одинаковых орбиталей - одинаковый энергетический уровень (их ещё называют вырожденными). К примеру, три p орбитали(p(x), p(y), p(z)) являются одинаковыми и имеют одинаковый уровень энергии. s орбиталь, конечно, будет иметь другой уровень энергии. В процессе гибридизации, все орбитали приобретают такую форму, чтобы электроны на них имели одинаковую энергию. Не трудно заметить, что самое выгодное расположению будет тетраэдрическим, а сами орбитали будут иметь форму той самой “an sp³ orbital” (an - просто артикль, если ты это имел ввиду). Если переложить информацию о том, что цвет не имеет значения на картинку с гибридными орбиталями, то нетрудно заметить, что два возможных электрона могут присутствовать в любом месте орбитали, т.е. в границах И красных лопастей, И синих, и зелёных
могу где-то ошибаться сам начал изучать органику 2-3 недели назад и еще не до конца понял даже первые главы.
Типо p орбитали и s орбиталь соединяются и образуют sp3 в котором один шарик большой а другой маленький и делается это для потому, что так выгодней образовывать связь? Тогда ведь у нас 3 p орбитали и лишь одна s это означает, что s орбиталь одновременно со всеми соединяется и каждому достаётся по 1/3 от s орбитали?
Тут, скорее, будет правильнее сказать, что, поскольку все гибридные орбитали равноценны, а s орбиталь у нас была всего лишь одна, четыре sp^3 будут иметь “одинаковое количество s орбитали”, т.е. \frac{1}{4}s (25%)
На данном этапе не имеет смысла искать тонкую связь между комбинацие орбиталей. Достаточно просто знать следующее:
- из каких атомных орбиталей образуются данные гибридные орбитали (в органике sp^3, sp^2 и sp)
- из n атомных орбиталей образуется n гибридных орбиталей ( из 3p и 1s=>4sp^3)
- как гибридные орбитали расположены вокруг ядра
( sp^3=>тетраэдр) - если это sp^2 или sp , то как относительно друг друга расположены гибридные и атомные орбитали
Р.с. атомные орбитали - орбитали до гибридизации (отдельные s и p