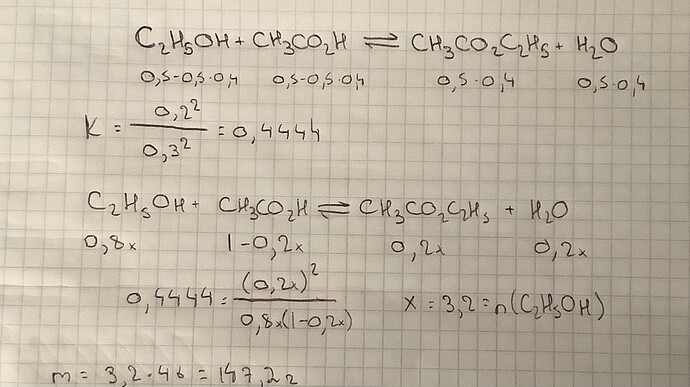При смешении по 0,5 моль 100%-х этанола и уксусной
кислоты выход реакции этерификации составил 40%. Рассчитайте константу равновесия. Какую массу этанола надо добавить к 1 молю уксусной кислоты, чтобы в реакцию при этой
же температуре вступило 20% спирта?
О т в е т. 147,2 г этанола.
Можете обьяснить решение задачи
Большое спасибо
Добрый день! Я был удивлен уведеть воду в константе. Получается в аналитике мы не влючаем в константы воду (константу равновесие)(мне всегда говорили что концентрация воды в воде это тупо). А в константы равновесие мы включаем воду(но по константа равновесие работает точно также)(выше есть пример где тоже включали,хотя не говорилось что раствор того то вва 100%).
Моя догадываюсь что в аналитике при раставоре больше молей воды и гораздо меньше соответсвенно растворенного вва. И изза того что конц воды очень велика его принебригают. Причина в этом? Можете обьяснить разницу между ними? Где нужно считать конц воды, а где можно принебречь?
В условии же написано, что 100 процентные растворы этанола и уксусная кислота, значит в изначальных растворах не содержится вода
Не думаю что в примере 10 говорится о том же. Хотя включали воду. Можно просто задать этот же вопрос под новой темой. Но смысл не меняется.
Вот пример 10
Когда мы рассчитываем константу равновесия, мы не учитываем растворитель. Потому что его изменение в реакции незначительное по сравнению с его концентрацией, потому чтобы было удобней его не включают.
Получается в примере 10 растворитель кислота и спирт тоже?Еще там по идее мольные доли. И из за того что степени одинаковые Шакир аби сократил?