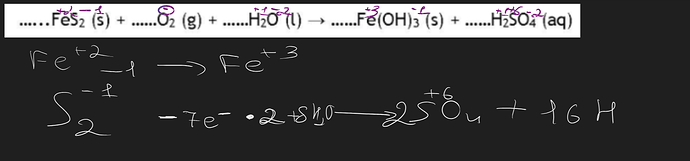Сначала определимся со степенями окисления у элементов слева и справа. Так как в пирите идет анион \ce{S2^{2-}}(с.о. серы -1), у железа с.о. будет 2+. В \ce{O2} с.о.=0 . Справа железо в +3, а у серы +6.
Чтоы уравнять с помощью полуреакций, нужно брать катионами и анионами, а не элементами. Все, что solid не диссоциирует на ионы в воде, и мы должны брать их не ионами, а не распавшимися. Например, пирит и гидроксид железа solid, поэтому мы берем их как \ce{FeS2} и \ce{Fe(OH)3}, а не \ce{Fe^{2+} , S2^{2-}, Fe^{3+}, OH-}. Вот начальная схема
\ce{FeS2 -> Fe(OH)3 + SO4^{2-}}
Сульфат в форме аниона так как H2SO4 растворим в воде(aq=aqueous), и диссоциирует полностью на ионы: \ce{H2SO4 -> 2H+ + SO4^{2-}}
Ставим перед сульфатом двойку, чтобы уравнять серу
\ce{FeS2 -> Fe(OH)3 + 2SO4^{2-}}
Слева не хватает 11 кислородов, поэтому добавляем слева 11 молекул \ce{H2O}:
\ce{FeS2 + 11H2O -> Fe(OH)3 + 2SO4^{2-}}
Теперь справа не хватает 19 водородов, добавляем справа 19 ионов \ce{H+}:
\ce{FeS2 + 11H2O -> Fe(OH)3 + 2SO4^{2-} + 19H+}
Все уравнялось, теперь посчитаем заряд. Слева заряд 0, справа -4+19=15, отсюда
\ce{FeS2 + 11H2O -15e- -> Fe(OH)3 + 2SO4^{2-} + 19H+}
Остался кислород, который слева был с с.о.=0, а справа с с.о. -2.
\ce{O2 -> O^{2-}}
Но стой, у нас нет в растворе \ce{O^{2-}}… Можно написать одно из двух, \ce{OH-}\ или \ \ce{H2O}, в обоих он в с.о.=-2. Так как ранее мы использовали пару \ce{H2O/H+}, возьмем \ce{H2O}:
\ce{O2 -> H2O}
Точно так же как ранее уравняем эту реакцию, и получим:
\ce{O2 +4H+ +4e- -> 2H2O}
НОД 4 и 15=60, поэтому уравнние с 15 электронами умножаем на 4, а уравнение с 4 электронами умножим на 15:
\begin{array}{rcl}
\ce{4FeS2 + \cancel{44}H2O \cancel{\ce{- 60e-}}} & \ce{->} & \ce{4Fe(OH)3 + 8SO4^{2-} + \cancel{76}H+}
\\
\ce{15O2 + \cancel{\ce{60H+}} \cancel{\ce{+60e-}}} & \ce{->} & \cancel{\ce{30H2O}}
\\
\hline\ce{4FeS2 + 14H2O + 15O2} & \ce{->} & \ce{4Fe(OH)3 + 8H2SO4}
\end{array}