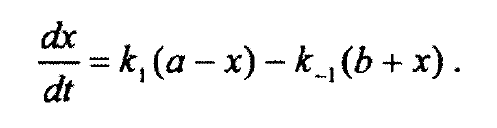
Из этого уравнения выходит это уравнение:
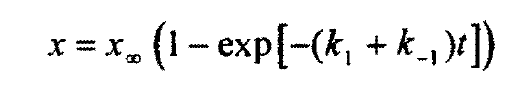
Могли бы вы объяснить вывод этой формулы?
P.S. Есть база по мат. анализу.
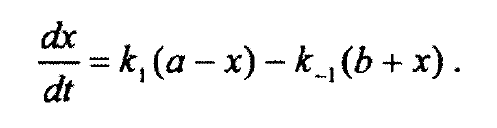
Из этого уравнения выходит это уравнение:
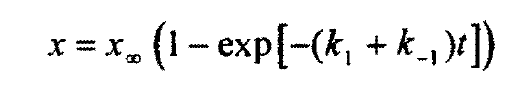
Могли бы вы объяснить вывод этой формулы?
P.S. Есть база по мат. анализу.
Чекни ВВЕДЕНИЕ В ХИМИЧЕСКУЮ КИНЕТИКУ от А. В. Леванова
Дам подсказку, с помощью которой можно самому придти к выводу этой формулы.
В данном контексте x - это отклонение текущей концентрации от равновесного состояния:
Для начало посмотрите на раскрытие скобок. Мы получим ka-k’b+… Известно, что при равновесии скорость обратной и прямой реакции равны. А значит они оба сократятся. У нас останется -kx-k’x. x×(-1)(k+k’)
x переносим налево, dt вправо, интегрируем.
Я думал он спрашивает конкретное происхождение данной формулы, а не конечное выражение для x, ибо
это вроде бы имплицитно подразумевало то, что он знает как интегрировать