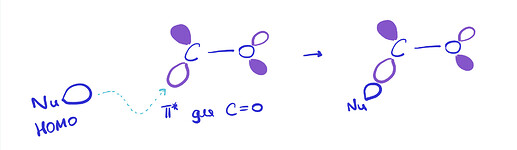Вот текст из книги:
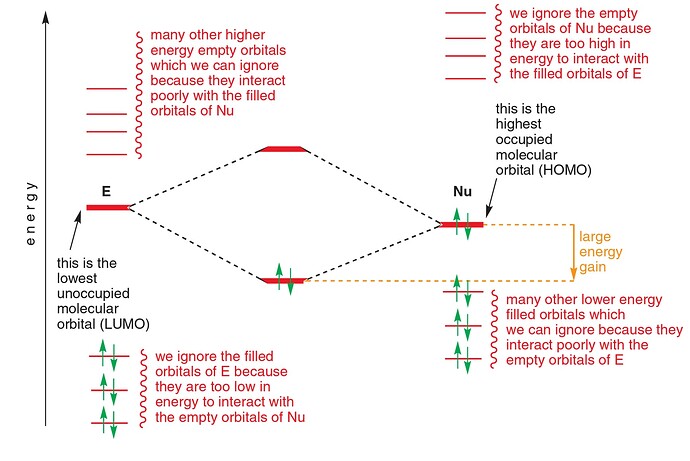
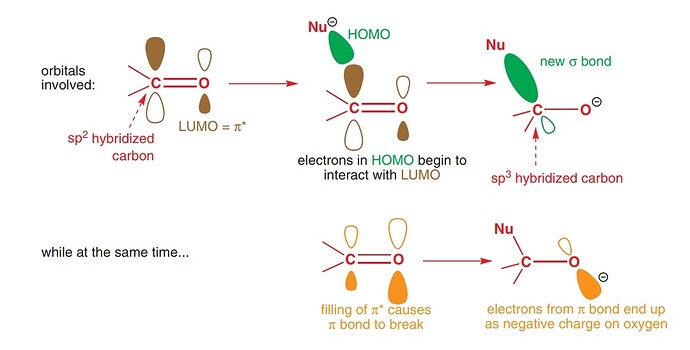
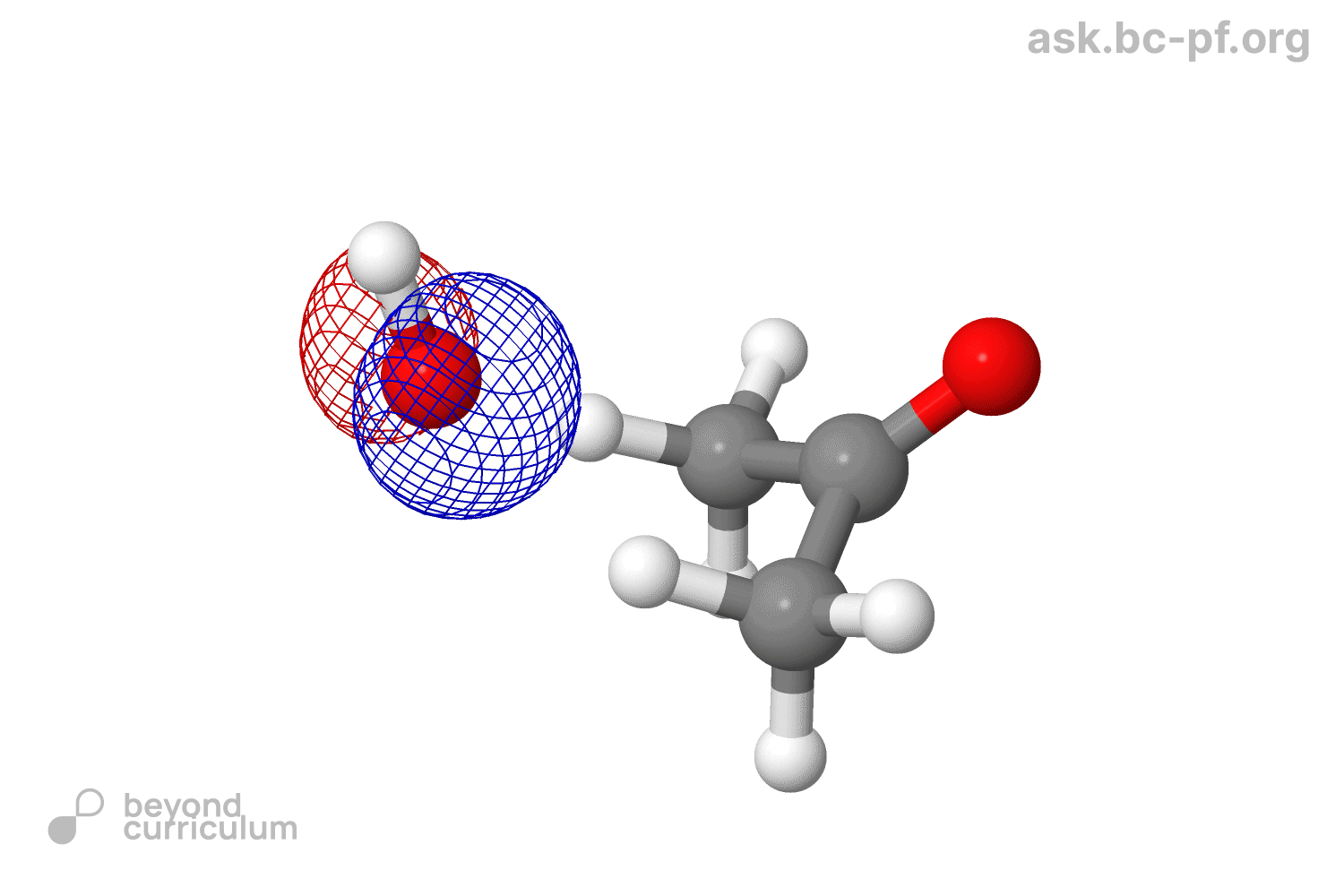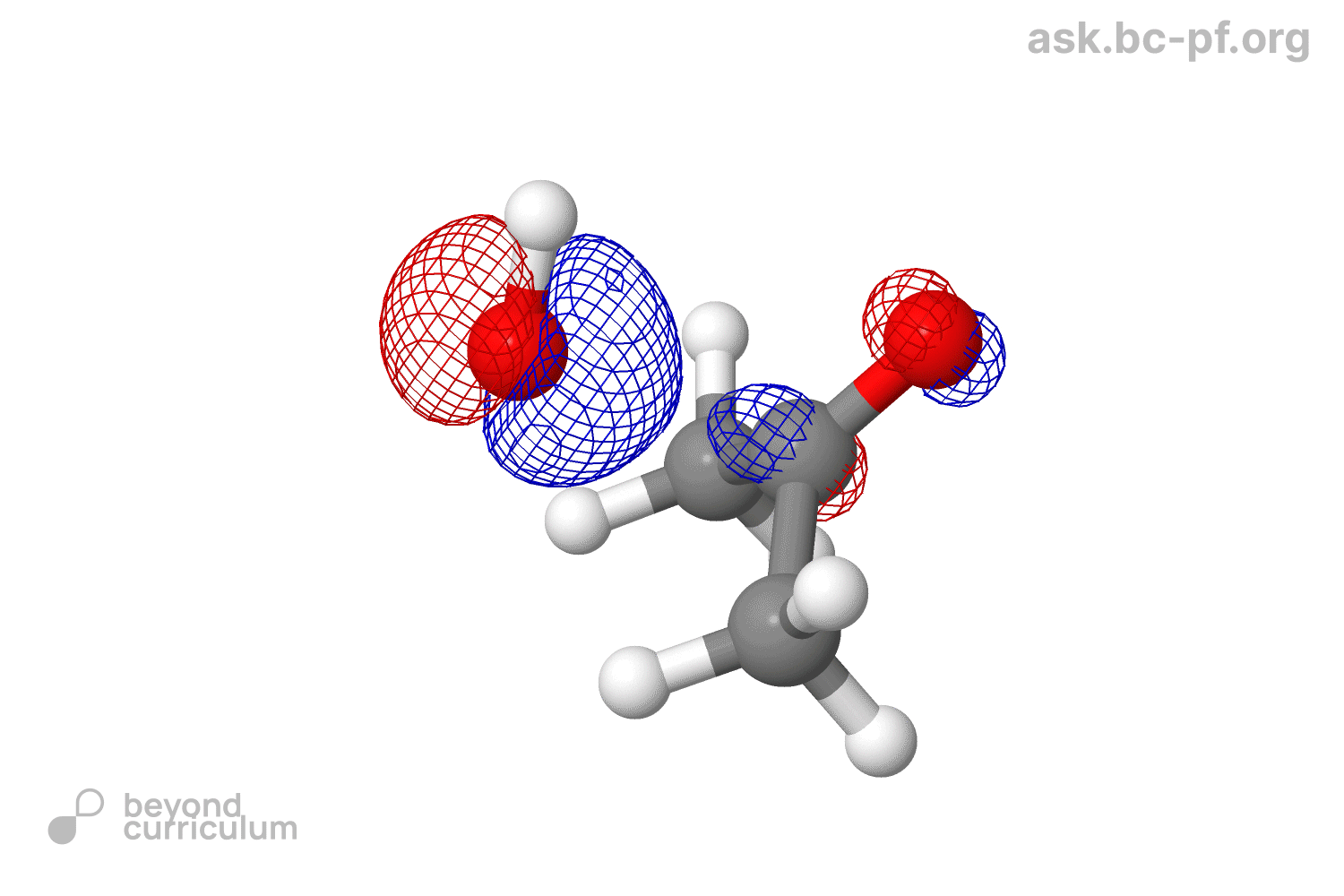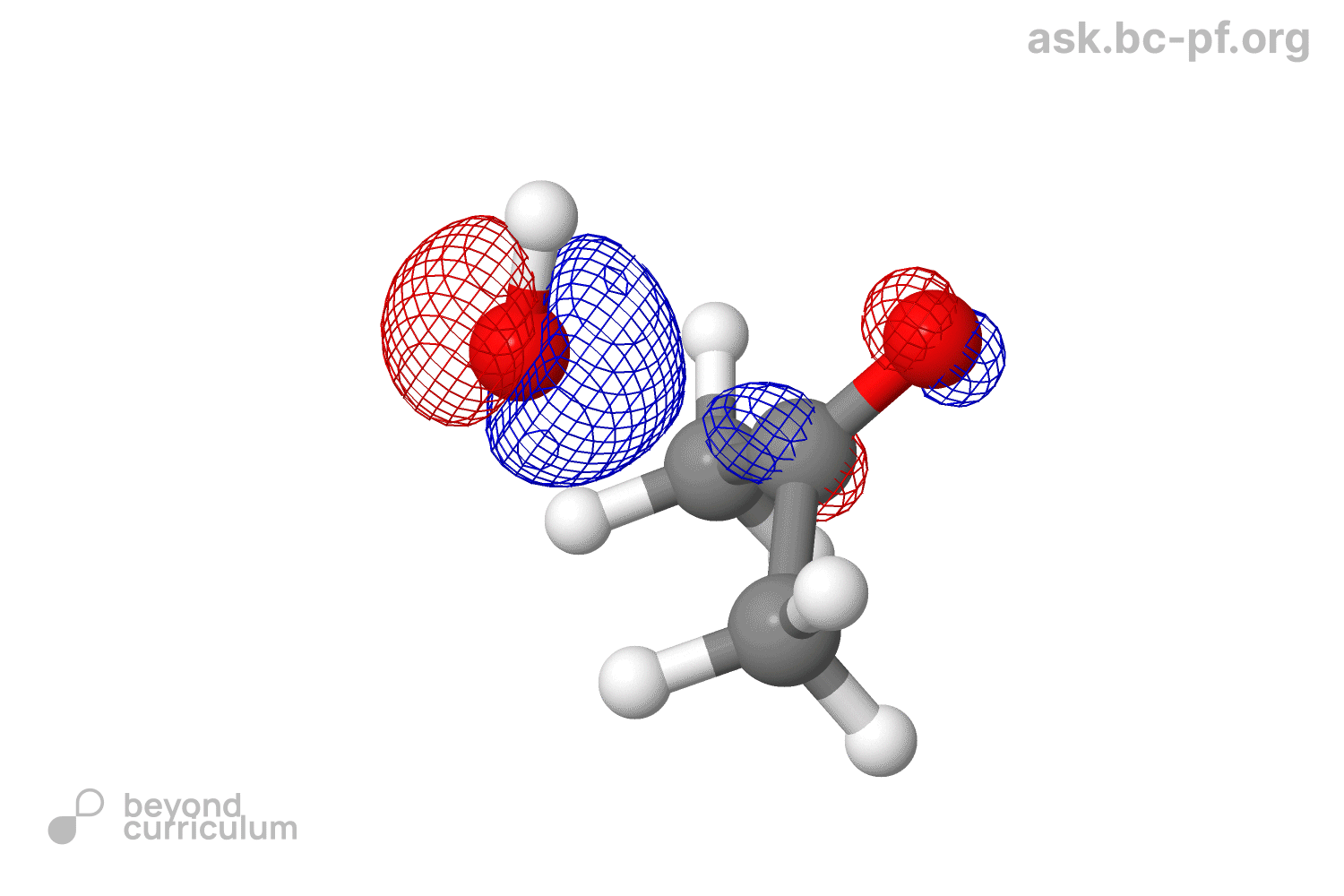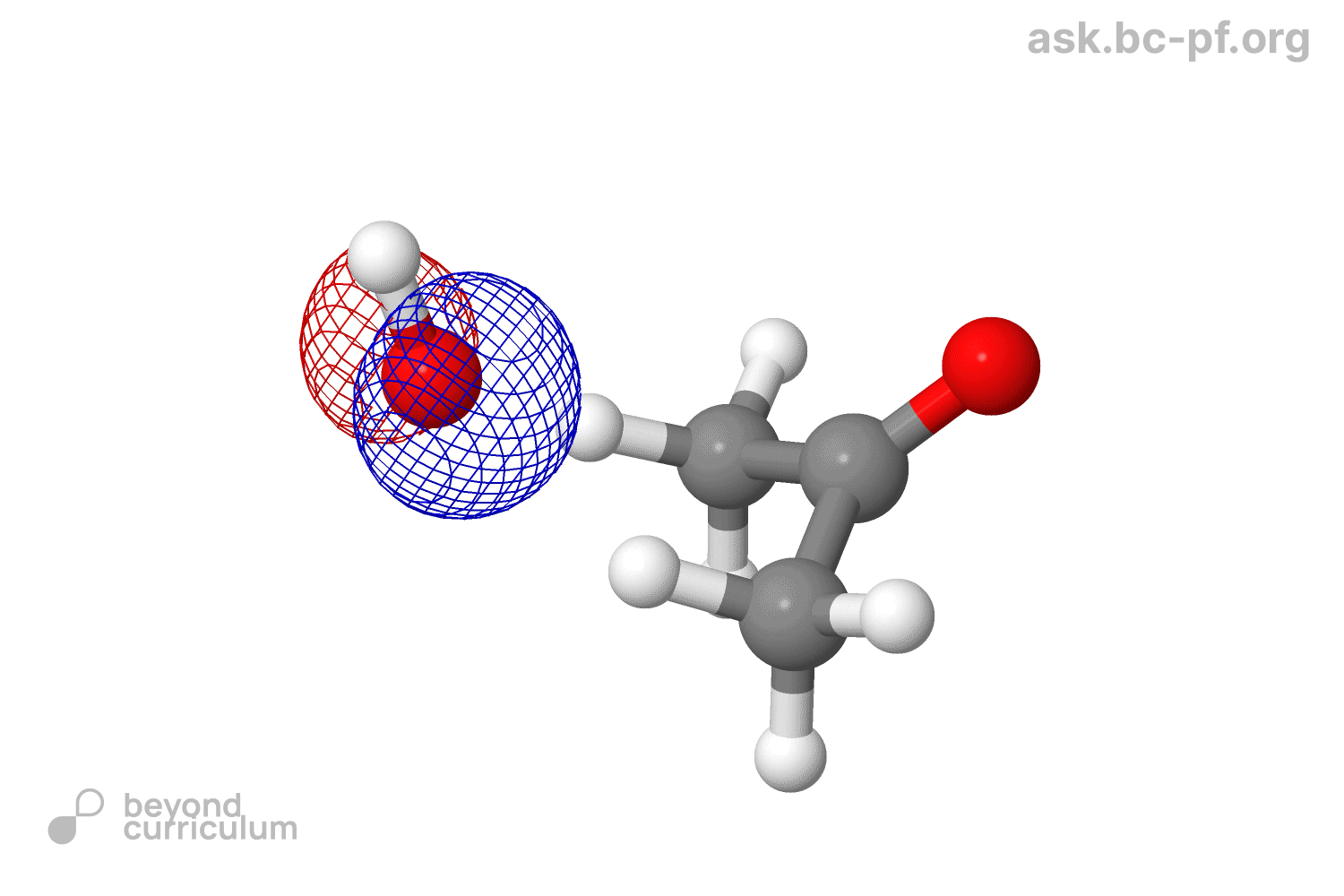
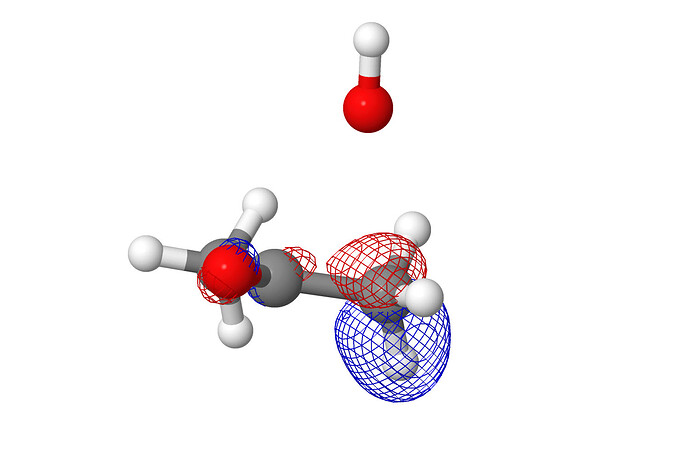
As our nucleophile—which we are representing here as ‘Nu−’—approaches the carbon atom, the electron pair in its HOMO starts to interact with the LUMO (antibonding π*) to form a new σ bond. Filling antibonding orbitals breaks bonds and, as the electrons enter the antibonding π* of the carbonyl group, the π bond is broken, leaving only the C–O σ bond intact. But electrons can’t just vanish, and those that were in the π bond move off on to the electronegative oxygen, which ends up with the negative charge that started on the nucleophile. You can see all this happening in the diagram below
Итак по порядку
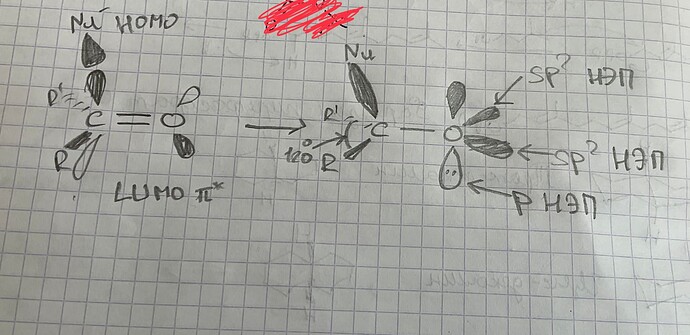
- HOMO реагирует с LUMO, образуя две новые \sigma и \sigma^{*} MO:
- Filling antibonding orbitals breaks bonds and, as the electrons enter the antibonding π* of the carbonyl group, the π bond is broken, leaving only the C–O σ bond intact . Почему говорят что мы заполняем π*? Мы же не заполняем ее: она взаимодействует с HOMO, и образует еще две МО, а заполняем мы новую образовавшуюся σ МО.

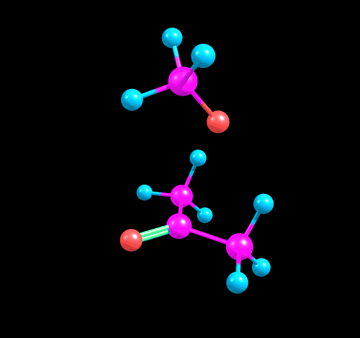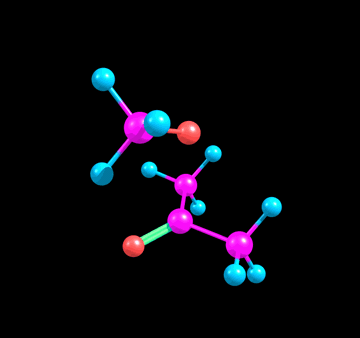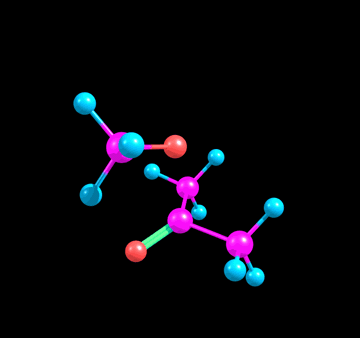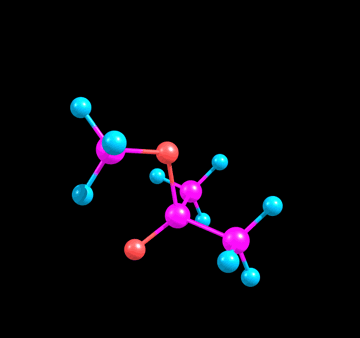
- В этом же предложении еще одна непонятка. Окей, нсмо с взмо реагируют. Все, нету больше у нас π*. А что делать π связывающей? Что ей делать без своего π*? Говорят, что π связь сломалась, значит этой π связывающей вообще не должно быть (ну нету связи, о какой связывающей может идти речь). Я предлагаю вот что: при разрыве связи, две МО (связ, разр) обратно превращаются в две АО (2p). Так как одна МО уже ушла с взмо нуклеофила, вторая просто превращается (?) в 2p. В итоге получается анион-кислород с НЭП на p орбитали, и кое-что такое:
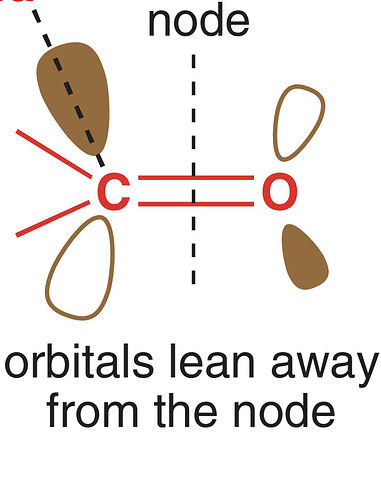
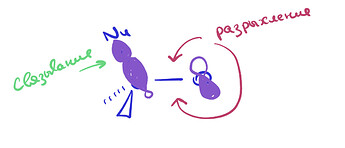
чего тут примечательного от реального продукта: угл между тремя связями углерода остался 120° (ну и правильно, зачем ему менятся). Нуклеофил связан не под 90°, а чуть под углом, потому что сама π* так под углом стоит, отклоняясь от узла:
Такое чувство, будто я несу полнейший бред - А так выглядят настоящий продукт
Тут лишь один большой воспрос: как все превратилось в sp3?