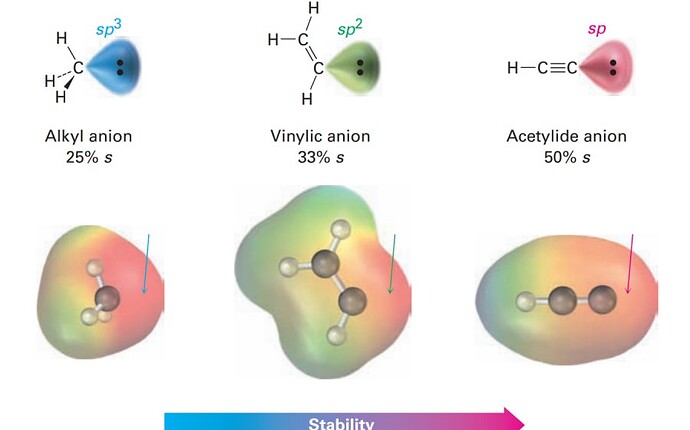
Добрый день! Тут по electrostatic potential map мы можем понять, что алькильный анион будет более основней, чем винильного и ацетилидного. И почему же это так? Если мы посмотрим на алькильный анион атом углерода забирает всю электронную плотность на себе. А у винильного и ацетилидных анионов возможно есть гиперконъюгация, где электроны будут равномерно расположены так скажем почти по всей молекуле. но забывать того факта, что углерод, на которой НЭП будет так же всю электронную плотность забирать на себе.
Неужели все дело в распределений электронной плотности по молекуле? Она типо зарешало что из них будет основней
В алкильном анионе неподеленная электронная пара находится в sp^{3} - орбитали, в винильном анионе она находится в sp^{2} -орбитали, а в ацетилид анионе она находится в sp - орбитали. Поскольку энергия sp^{x} орбиталей возрастает с ростом x (0 \le x \le 3), вполне справедливо, что мы замечаем уменьшение основности слева направо. К слову, об этом и писалось в книге прямым текстом, учитывая то, что внизу всех трех анионов написали s-характер каждого атома углерода.
Вот то, что вы сказали влияет на стабильность, но как оно влияет на основность? Основность это - когда молекула может поделиться электронной парой. Как эти 2 вещи связаны? Либо глупый вопрос, либо же нужно идти спать
Обычно чем стабильнее сопряженное основание, тем сильнее кислота. Чем сильнее кислота, тем слабее основание.
чем стабильнее образующийся продукт, тем ему легче образоваться, и наоборот. В данном случае мы видим, что ацетелидный анион стабильнее остальных, значит в качестве продукта ему выйти легче. а алкильный анион наоборот, менее стабильный значит ему больше хочется перейти в более стабильную форму. и у нас есть концепт, что всегда должны образовываться более стабильные основания и кислоты, чем те что были. И если мы сравним их pKa будет видно, что у алкильного он нааамного больше чем у ацетильного, что означает что он более основной, т.к менее стабильный
А мое выше написанное в какой-то степени, с другой точки зрений может ли быть верным на счет основности?
по сути, да. основность - понятие относительное. этим словом американский физхимик Гиллберт Льюс просто обозначил молекулы, которые могут задонатить пару электронов и все. можно просто сказать " это вещество хорошо донатит электроны", но тут нужно задаться вопросом: почему некоторые вещества лучше донатят пару электронов чем другие ? и на этот вопрос химики уже дали ответ и вывели закономерность, которая всегда работает. всегда образуются кислоты/основание, которые более стабильные чем реагенты, и тут возникает второй вопрос: как узнать какие вещества более стабильные, а какие нет? на этот вопрос химики тоже дали ответ: чем ниже pKa у основании тем они стабильнее и чем выше pKa у кислот тем они стабильнее. Получается делаем выводы, что по pKa можно сравнивать стабильность молекулы, а на стабильность уже влияет другие вещи, с которыми вы уже скорее всего знакомы. в данном случае только гибридизация атома, из-за того, что sp обладает более низкой энергией чем sp3