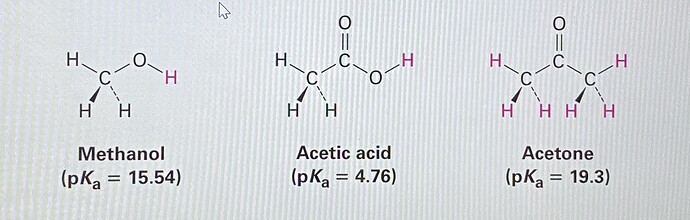
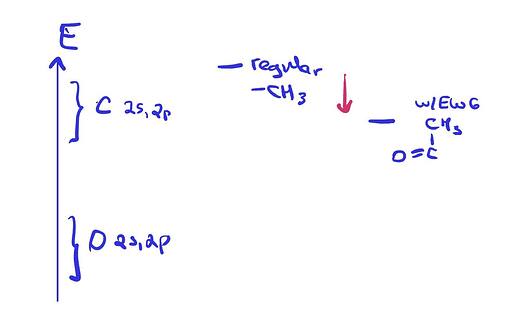Как можно объяснить то, что ацетон является кислотой намного слабее по сравнению с уксусной и метанолом, хотя вроде у них у обоих (ацетон с уксусной) анион стабилизирован резонансными структурами, то есть не зная значения рКа, можно бы было предположить что ацетон сильнее метанола?
рКа ацетона 19,3 а метанола 15,54
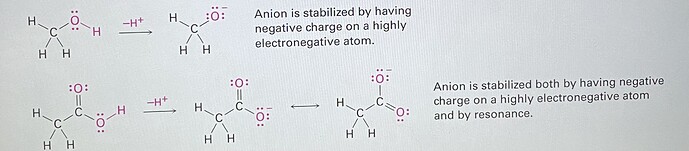
The acidity of acetone and other compounds with C=O bonds is due to
the fact that the conjugate base resulting from loss of H+ is stabilized by resonance. In addition, one of the resonance forms stabilizes the negative charge
by placing it on an electronegative oxygen atom.
тогда если тут объясняется стабильность аниона ацетона, почему он не сильная кислота
ну вообще для связи С-Н рКа 19.3 это довольно мало(у простых углеводородов он в районе 40-50, а тут резонанс с карбонилом значительно его понижает), а метанол и уксусная кислота это вообще другое ибо там разрывается связь О-Н, кислород это электроотрицательный атом и для него отрицательный заряд нести энергетически выгоднее чем углероду
Чекнул pKa ацетона намного ниже уксусной кислоты и метанола, в кислотности ацетон никак не проиграет этим двоим
То есть прикидывать силу кислот можно только если водород отщепляется от одинаковых атомов?
Ой простите перепутал
ну вообще сила кислоты зависит от того, насколько стабильно сопряженное основание, то есть если у нас отрицательный заряд на электроотрицательном атоме или есть его делокализация, то эти факторы будут стабилизировать анион и делать кислоту сильнее. Наверное, в большинстве случаев кислоты полученные отрывом протона от атома кислорода будут сильнее чем таковые полученные отрывом протона от углерода, но есть и исключения
у этого соединения, например, рКа в районе 9 что означает, что оно кислотнее какого нибудь метанола
У меня тоже возник вопрос но, я помню что COOH более кислый чем кетон группа. За счет того что у COOH есть lone pairs которые будут кислее(резонанс). Этого обосновлено тем что делокализация будет ( стабильность лучше) . Или можно логический сравнить как кто то написал выше электроотрицательный атом должен брать минус заряд. А так же у них обоих есть С=О и сравнить С-СН3 С-ОН не оставит сомнения о том что COOH группа кислее.
Причину именно этого факта и пытается понять автор вопроса.
Так, вопрос – а причем тут НЭП? Если речь идет о депротонации, а не о протонации? Хотя правильнее начать с вопроса – а что такое кислая электронная пара? Первый раз такое слышу.
А при депротонации ацетона делокализации не будет?
А у меня, если читать только ваши утверждения, сомнения остаются.
Тезис №1. Он верный.
Не понимаю как это следует из Тезиса №1. Из тезиса №1 можно было бы предположить, что они обладают похожими pKa (тезис №1 говорит о том, что есть у обоих молекул, тогда почему одна должна быть кислее другой?)
Я уже где-то писал, что стабильность – понятие относительное. Человек стоящий на двух пальцах одной ноги более стабилен, чем человек, стоящий на одном пальце одной ноги. И тем не менее, по сравнению с человеком, который просто стоит на двух ногах первые два гораздо менее устойчивые.
Конкретно в данном случае важно помнить что да, EWG и EDG группы могут сильно менять кислотность тех или иных связей, но если EWG/EDG группа одна, ее эффект редко превосходит первоначальную разницу энергий атомных орбиталей.
Что определяет стабильность аниона? Энергия орбитали, на которой находится НЭП. Чем ниже эта орбиталь, тем лучше.
Присутствие карбонильной группы, благодаря резонансной делокализации, понижает энергию орбитали, на которой будет НЭП (красная стрелка). Но все равно этого недостаточно чтобы дойти до уровня энергии орбиталей кислорода.
p.s. рисовал в автобусе, поэтому криво