Почему называются именно сопряженными кислотами и основаниями? Сам какую-то закономерность вывил, что при гидролизе сопряженной кислоты образуется ионы [{H^+}]. А при гидролизе сопряженной оснований образуется [{OH^-}]. Из-за этого их так назвали? А еще почему \ce{H3O^+} является полностью бедной к электронам? Не ужели из-за наличий + заряда? То как это влияет на молекулу?(имеется в виду, что это просто лишняя связь). Как по мне электронная плотность должна быть у кислорода так, как он имеет как минимум не поделенную пару электронов.
Само слова сопряженное дает нам знать что оно с чем то связано. К примеру сопряженное основание, образуется с помощью донора протона кислоты(смотря с теорий Лоури) тесно связано с кислотой.
В химии есть такое понятие как амфолиты(вещества способные отдавать либо принимать протоны) , а вода один из амфолитов. Отсюда можно сделать вывод,что сопряженные основания будут отбирать (быть акцептором) протона у воды, а с кислотой тот же случай но просто наоборот.
В H3O есть лишний протон, который в свою очередь создает дыру в электронной плотности, и это нельзя назвать просто лишней связью
Сопряженный означает связанный с чем-то. И сам термин сопряженное основание (после реакции) имеет смысл только при наличии кислоты (до реакции). Более того, если записать реакцию обратно, то опять слева будут кислота и основание, а справа их сопряженные формы.
Это как я и моя сестра, которой я тоже прихожусь сестрой.
Всё намного проще объясняется, сопряжённые кислота и основание это частицы, которые отличаются \ce{H+}, у кого больше на \ce{H+}, того и кислотой кличем, поэтому в зависимости от пары, одна и та же частица может в разных случаях быть как кислотой так и основанием, т.е. это не общее название, а конкретно в контексте конкретной реакции кислотно-основной.
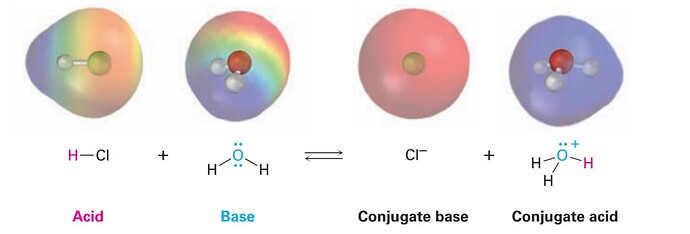
Например:
Да, из-за заряда. А влияет очень просто, это больше не молекула а ион ![]()
Важно понимать как образуется эта лишняя связь, особенно в сравнении с уже имеющимися. О-Н в воде образуется когда О и Н отдают по 1 электрону в общее пользование. Третья связь О-Н образуется когда неподеленная электронная пара кислорода забирает ион Н+, т.е. оба электрона приходят от кислорода.
Извините но я не очень понимаю, почему ион не может быть богатым по electrostatic potential map?
Все же у кислорода же есть 1 пара не поделенных электронных пар
Во-первых, богатство электронами штука относительная, нас обычно интересует насколько одна часть молекулы более богата электронами чем другая часть.
Во-вторых, electrostatic potential map, это внезапно electrostatic potential map, а не богатство электронами, т.е. надо понимать как оно считается и когда мы можем его так интерпретировать, а когда не можем.
Подобная карта показывает буквально электрический потенциал вблизи молекулы/иона, если частица заряжена, то потенциал вокруг иона всюду положительный (не всегда), да он меньше со стороны неподелённой пары, ведь там избыток электронов, но не отрицательный, а просто ниже чем со стороны водородов, т.е. если мы хотим изучить где у подобной частицы электроноизбыточная часть, а где электрон-дефицитная часть, то надо изменить правила отображения, сдвинув цветовую шкалу. Почему тут так не сделали? Либо потому что лень, и шкалу для нейтральной молекулы просто решили применить к заряженному иону, либо так и задумывалось, ведь абсолютное значение potential нас обычно интересует сильнее, чем избыточность/недостаточность электронов.