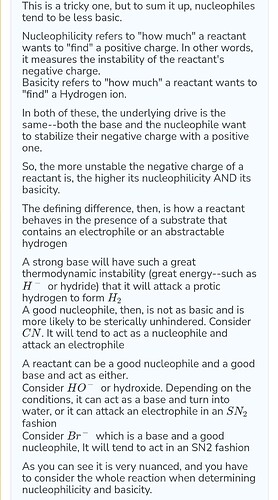
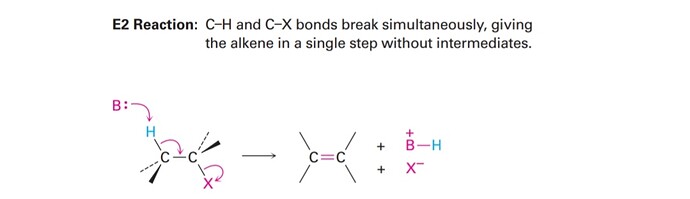
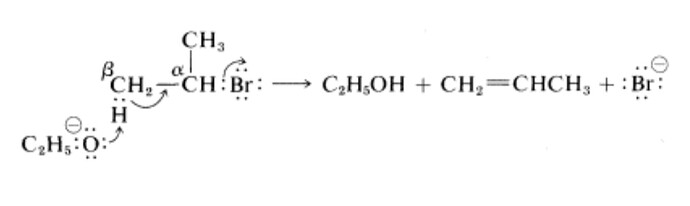Помогите пожалуйста, я оказывается вообще мало что понимаю.
1)Что подразумевают когда говорят об оснований? Они имеют ввиду ОН группу, или же сопряжённое основание кислот? Или же имеют ввиду любую молекулу с не поделённой электронной парой, как по теории Льюиса, может используют другие теории?
2) Считается ли любая молекула с не поделённой электронной парой основанием? Если да, то если кинуть любую такую молекулу в раствор, то раствор станет более основным?
3) Как можно определить какое основание сильное/слабое, и какой нуклеофил сильный/слабый , основание это лишь один из видов нуклеофилов?
4) Что мы обычно имеем ввиду под основной/ не основной нуклеофил? Основным мы его считаем, если он сопряжённое основание слабой кислоты получается?
Теперь вопросы со скриншота:
5) В Primary написано, что Е2 удаление происходит с сильным, стерический затруднённым основанием. Почему используют основание, а не нуклеофил, или это одно и тоже? Почему оно сильное, а не слабое к примеру? Почему он должен быть стерический затруднённым(в книге такого не было)?
6) В Secondary пишут, что SN2 реакция должна происходить со слабо основным нуклеофилом, но почему? В книге про такое вроде не было написано, наооборот намекали, что основание должно быть отрицательно заряженно, сильное и т.д
7) Почему в Е2 реакции используют именно сильное основание?
8) Почему в Sn1 и Е1 реакциях используют слабо основной нуклеофил? Вроде как природа нуклеофила не важна, значит может быть любой нуклеофил.
9) В Tertiary написано, что реакции SN1 и E1 происходят вместе в нейтральных условиях, под нейтральными условиями они имеют ввиду протический растворитель с нейтральным нуклеофилом, или каким?
Основания в органике - это то что может принять протон.
Например тут:
И да, вещества с неподелённой электронной парой можно считать основанием, но вопрос слабое оно или сильное.
Думаю да, к примеру давай возьмем аммиак у которого раствор слабо-щелочной.
«Чтобы определить основность молекулы, нужно посмотреть на рассматриваемый атом; однако теперь мы хотим сосредоточиться на том, какая электронная плотность сосредоточена на этом атоме. Чем менее стабильна молекула (что происходит, когда большая часть электронной плотности сосредоточена на одном атоме), тем больше она захочет отдать часть своей электронной плотности, приняв протон; следовательно, самым сильным основанием будет то, у которого электрон с наибольшей энергией (или то, на котором сосредоточена наибольшая плотность электронов, поскольку это вызывает большее электрон-электронное отталкивание, которое уменьшается после протонирования).»
Вот такие объяснения из гугла
Давайте сначала посмотрим на механизм реакций E2:
Основание должно быть сильным, потому что должен забрать протон. Слабым основаниям будет труднее забрать протон.
Думаю основная причина - стерически затрудненные основания являются слабыми нуклеофилами. Суть здесь в том, что чем объемнее данный нуклеофил, тем медленнее скорость его реакций [и, следовательно, ниже его нуклеофильность].
Поэтому основания отщепляет протон и пойдет Elimination reaction, a не substitution.
Почему, ведь если основание сильное то скорее пойдет E2 реакция.
pKa у относительно сильных кислот низкий, и если у основания conjugated acid с высоким pKa, значит оно плохо отдаёт протон, значит ему легче взять протон чем отдать, получается:
У кислоты низкий pKa=сильная кислота=легко отдает протон=плохо принимает протон=сопряженное основание слабое. Мы смотрим по conjugated acid силу основания\кислоты.
и какой нуклеофил сильный/слабый , основание это лишь один из видов нуклеофилов?
про это написано в прошлом параграфе, вкратце расскажу о чем там:
-Когда можно сравнивать нуклеофильность(вы назвали её силой нуклеофила) основностью?
-Что такое нуклеофильность? и кто нуклеофильнее?
Основным мы его считаем, если он сопряжённое основание слабой кислоты получается?
Ну, с полной уверенностью сказать не смогу, однако предполагаю что да.
Что подразумевают когда говорят об оснований?
Основания по Бренстеду-Лоури или по Льюису. Разницы нет. ОН- тоже основание БЛ/Льюиса.
Считается ли любая молекула с не поделённой электронной парой основанием?
Строго говоря, по Теории Льюиса – да.
то раствор станет более основным?
Основность раствора определяется через pH. У Cl_2 есть неподеленные электронные пары, однако основным раствор станет только если будет протекать реакция:
Я так полагаю вы уже поняли, что не все основания Льюиса делают среду более основной.
Как можно определить какое основание сильное/слабое
По pK_B=14-pK_A.
какой нуклеофил сильный/слабый
Математической шкалы нет, тут много факторов. Понимание приходит с опытом (через пару месяцев, минимум)
основной/ не основной нуклеофил?
Является ли он сильным основанием. Все нуклеофилы, по определению, основания Льюиса, но далеко не все из них сильные основания. Скажем \ce{t-BuO-} сильное основание, а вот \ce{I-} нет.
Почему используют основание, а не нуклеофил
Потому что нуклеофил будет атаковать углерод с образованием продукта замещения. Поэтому мы и используем стерически затрудненную молекулу, которая не может добраться до атома углерода и лишь забирает атом водорода, который торчит “на поверхности”.
слабо основным нуклеофилом
Чтобы нуклеофил доходил до атома углерода и атаковал по нему, а не забирал атом водорода (для протекания элиминирования).
Почему в Е2 реакции используют именно сильное основание?
Ну нам же протон надо отщепить, нужно основание.
Почему в Sn1 и Е1 реакциях используют слабо основной нуклеофил?
Если природа нуклеофила не важна, зачем использовать сильные основания? С сильными основаниями сложнее работать, они более капризные, более опасные/токсичные. Вопрос прагматики.
нейтральными условиями они имеют ввиду протический растворитель с нейтральным нуклеофилом,
типа того.
Вообще, дам совет – не пытайтесь найти четкие границы: вот это жб для S_N2, вот такой растворитель жб для E1 и так далее. Эти границы, по большому счету, очень размытые. Я тоже в свое время пару раз перечитывал 11 главу в надежде понять: polar - это одно, nonpolar – другое, polar aprotic – третье. Но там все равно так или иначе есть пересечения.
И лучшее, что можно сделать – пойти дальше. Со временем, с каждой реакцией, с каждым синтезом вы станете лучше понимать какие кондиции хороши для той или иной реакции.
Обсуждали ранее эту тему
Обсуждали ранее эту тему
Я так и не понял
Спасибо вам, и всем остальным за помощь)