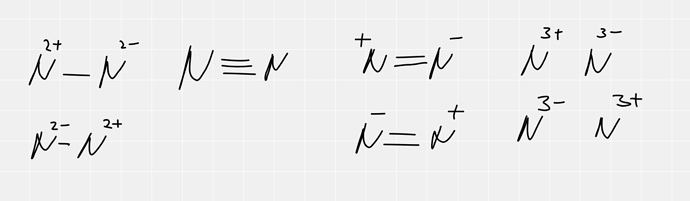Почему здесь кислород отдаёт пару в сопряженную структуру:
А вот здесь, уже наоборот отбирает:

?
Лично мне кажется более логичным второе, так как кислород самый электроотрицательный и следовательно берет на себя весь отрицательный заряд ради стабильности всей молекулы.
Ну… во-первых термин “перенос электронов” уже занят в другой области химии, так что будь аккуратен с формулировками.
Теперь по поводу вопросов. Т.к. в реальных молекулах электронная плотность атомов распределена по всем атомам молекулы, то в принципе наша попытка изобразить структуру с помощью обобщенных пар изначально обречена на провал. Но если бы мы могли использовать смесь (как суперпозиция), разных структур, то могли бы приблизиться к электронному строению. Тут сразу нужно оговориться, что для резонансных структур можно вообще любое дикое перераспределение зарядов придумать, и это будет валидной резонанской структурой, только вот её вклад в общую картину будет мал.
Теперь к примерам, возьмем молекулу азота, какие структуры мы можем для неё придумать. Да целую кучу
Только вот у ионных структур (особенно у структур с зарядом больше 1) вклад будет настолько мал, что можно пренебречь им. Мы же вроде знаем, что азот неполярная молекула. Но при этом молекулы азота друг к другу притягиваются Ван-дер-Ваальсовыми силами (жидкий азот же существует), и можно легко считать, что эти силы рождаются от взаимодействия ионных резонансных структур. Неудивительно, что они такие слабые.
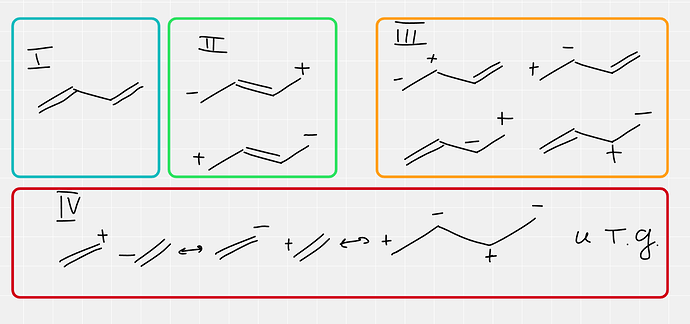
Теперь возьмем пример органический — бутадиен-1,3
Я поделил структуры на разные группы
Первая структура это основная, это понятно наверное и так
Вторая и третья группы структур тоже вносят значительный вклад в электронное строение молекулы, и вторые структуры как раз показывают нам сопряжение. Из-за них молекула даже геометрию меняет. Симметричные друг другу структуры вносят одинаковый вклад, структуры где плюс на вторичном углероде вносят больший вклад чем их аналоги с плюсом на первичном атоме (это тоже наверное понятно почему).
Структуры четвертой группы вносят самый малый вклад, так как неполярные сигма связи между атомами углерода, представленные в ионном виде это дело неблагодарное, сигма связи плохо поляризуются и поэтому структуры автоматически плохой вклад вносят (если речь про элементы второго периода, у какого-нибудь йода такие структуры отлично заходят)
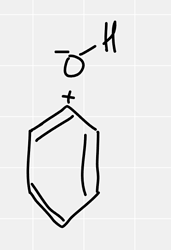
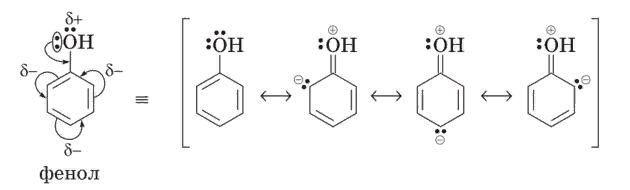
А теперь взглянем на фенол, можем ли мы нарисовать структуру, где кислород взял себе минус и порвал сигма связь с углеродом? Да, можем, эта структура как раз объясняет индуктивный эффект и полярность связи C—O в феноле, но её вклад очень мал, т.к. это сигма связь между кислородом и углеродом.
А вот варианты где что-то изменено в пи-системе, они больший вклад вносят (т.к. легче поляризуются, и разрыв двойной связи это легче),так еще и просто берут количеством, их тупо много, даже если каждый 4% внесет, три структуры, около 12% закинут. И в случае фенола, кислород в sp2 гибридизации, чтобы облегчить жизнь для этих структур, усложняя жизнь основной структуре
Алсо, структур где сигма связь O—H представлена в ионном виде целая куча, и это они виноваты в кислотности фенолов и полярности OH группы