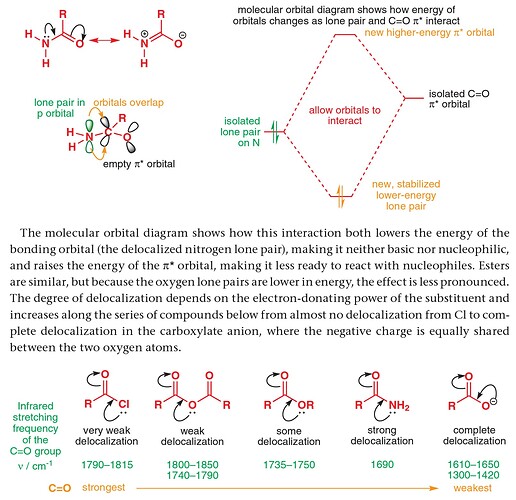
Почему у эфира больше делокализации, чем у ангидрида? Хотя у ангидрида кислород не с одной, а двумя карбонильными группами делокализован.
Разве не влияет то, что кислород может в обе стороны электроны дать? В среднем на одну карбонильную группу тогда будет меньше приходится электронов.
Не, там другой прикол.
электронная пара, которую мы рисуем снизу она находится в плоскости бумаги, т.к. она участвует в n\to\sigma^* взаимодействии. Этим собственно и объясняется то, что эфиры находится в Z-конформации (смотрим по по =О и О-R). Так что вот эта электронная пара, которая есть у ангидрида, не способна делокализоваться в \pi^*
У него же их две, одна в p орбитали, и одна в sp2. Вы имеете ввиду, что нарисовали ту, которая в sp2, которая взаимодействует с σ*? Это же происходит и в эфире и в ангидриде. А пара в p орбиталях все ещё может делокализоваться с π*, и у ангидрида она с двумя π*, что не уменьшает делокализацию, а только увеличивает ее.
Ой, я поплыл, было поздно и я хотел спать. Вот поэтому я не люблю когда показывают электронные пары лишь частично.
Да, действительно их две.
вот как раз о чем говорил @Abilmansur: НЭП кислорода делокализуется в две карбонильные группы сразу. Т.е. каждая испытывает условно эффект от половины электронной пары. Поэтому и суммарный эффект меньше.
Вопрос не только в том куда пара может ходить, а в том какая электронная плотность между конкретными атомами С и О (что и определяет частоту поглощения)