-
Клейден сперва говорит что важна симметрия при вставлении узловой плоскости, а тут в разрых МО на симметрию вообще по барабану?
-
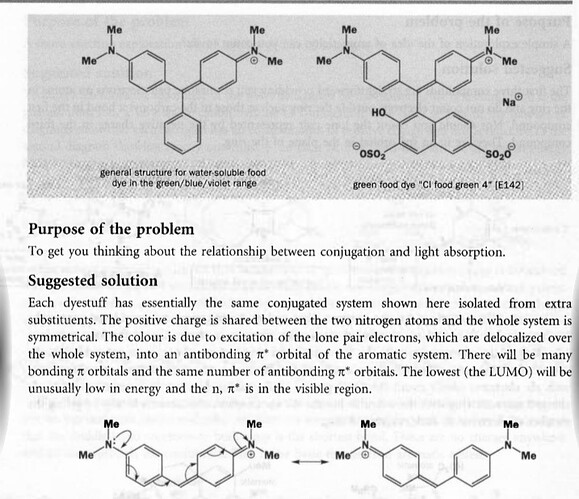
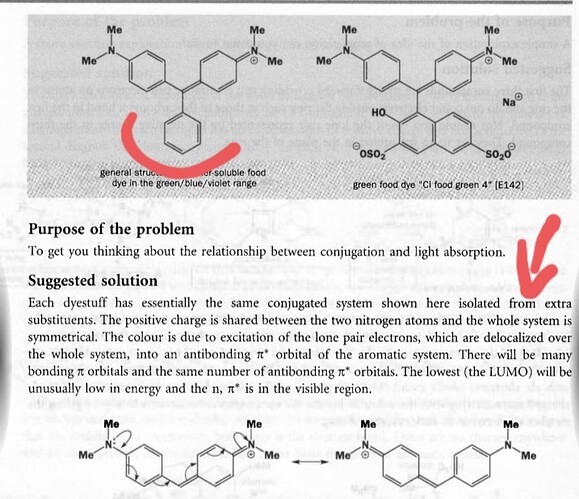
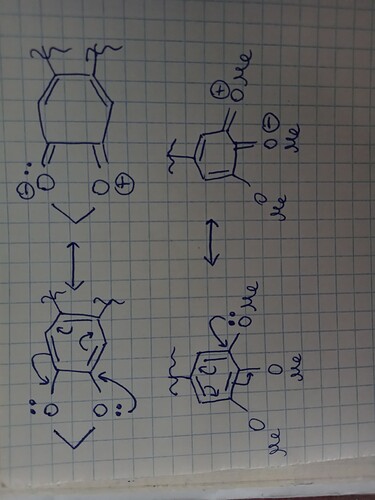
а почему он убрал экстра заместитель? Он ведь играет важную роль в понижении Энергии МО
-
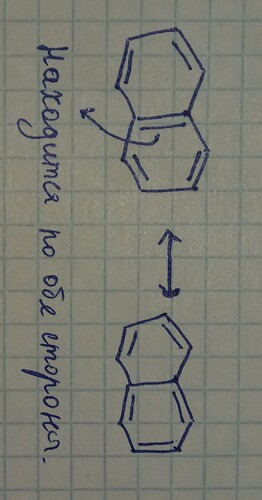
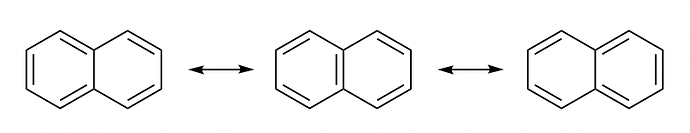
Почему у Нафталина все связи не эквивалентные?
-
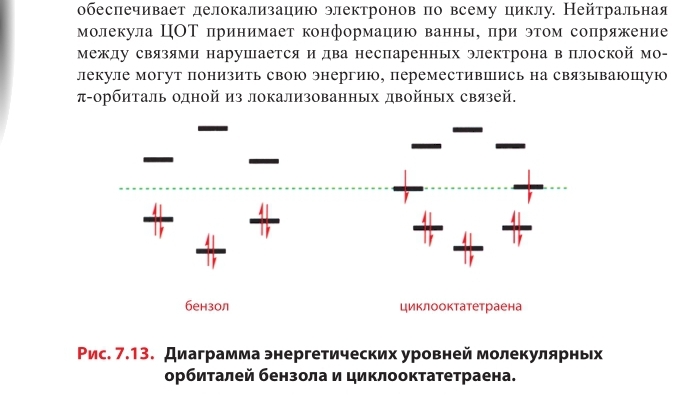
Всмысле, как электрон прыгнет на полностью занятую орбиталь?
-
Можете нарисовать здесь резонансную структуру? Хочу проверить свой ответ
Заранее спасибо. Кстати, как насчет добавить Клейдена в теги
Я не знаю, что именно говорит Клейден, но эти МО выходят из теории групп, а группами в данном случае являются точечные группы симметрий молекул. Строго говоря проблем там нет, конфуз может быть только при “альтернативном” объяснении без математики теории групп, я так полагаю.
Я не понял что вы имеете в виду. Кто убрал? Какой заместитель? Где?
Нарисуйте все возможные резонансные структуры?
Он не прыгает на нижезаполненные орбитали. Речь идет о том, что когда молекула перестает быть плоской, у нас уходит сопряжение двойных связей, а значит меняется и вся диаграмма МО. Грубо говоря мы будем приближаться к четырем копиям МО этилена.
Покажите ответ)
На разных углеродах разная электронная плотность и поэтому длины связей отличаются?
Не бейте только, мне еще на респу идти надо)
Ну так в чем логика Клейдена противоречит расставлению орбиталей для трех атомов? Там точно так же в одной из МО узел проходит через один атом. И Клейден осторожно говорит про “сохранение требований симметрии”, он не уточняет что за требования.
И? Они просто говорят, что у обоих молекул есть одинаковый фрагмент и показывают его. В чем проблема? Напишите словами. Еще полезнее если вы отправите в чем собственно суть задачи, что они просят сделать с двумя структурами.
Я не знаю, что вы вкладываете в понятие “разной электронной плотности”, а поэтому не могу ни подтвердить, ни опровергнуть этот тезис. Либо покажите структуры, либо скажите что вы имеете в виду.
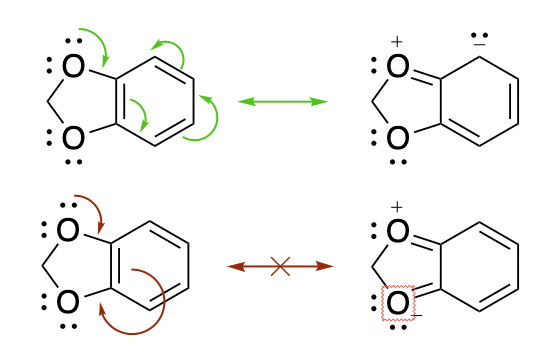
Нет, так нельзя. Кислород не может принимать дополнительную электронную пару ибо тогда у него будет 10 электронов. Вы можете это заметить если будете рисовать все электронные пары кислорода.
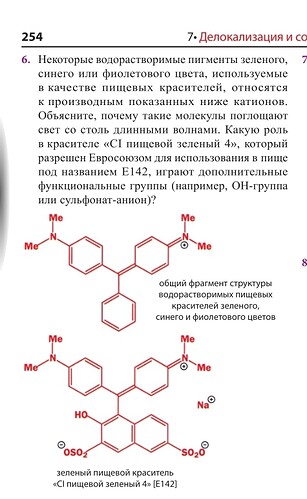
А, не, я разобрался. То есть общий фрагмент это причина поглащения, а разные заместители снизу варируют цвет
Ну я подумал что раз эта п-связь находится по обе стороны, то шанс найти электрон на этих углеродах выше чем на других(ну да, если забыть про делокализацию) Ну и подумал может из-за этого длины связей различаюся
Надо не думать[1], а рисовать резонансные структуры.
Обратим внимание, что в резонансных структурах слева и справа “полностью ароматичное кольцо”[2] только одно (левое и правое соответственно). А в центральной структуре оба кольца полностью ароматичны. Значит у центральной структуры будет больший вклад в резонансный гибрид. Отсюда и вывод у каких связей длина ближе к длинам двойных связей, а у каких ближе к длинам одинарных
Звучит как цитата. Всё предельно ясно как предельные углеводороды. Большое спасибо