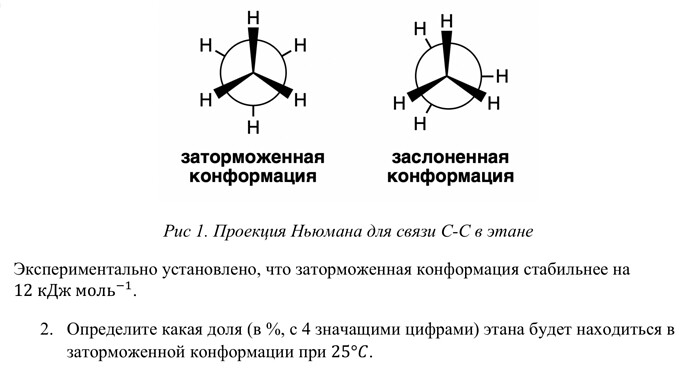
Вещество А превращяется в вещество В, потому что вещество В стабильнее. В какой-то момент времени устанавливается равновесие. Но почему? Если В стабильнее чем А, то реакция на 100% должна же сдвинутся вправо.
Сколько Клейдена читаю, тут везде это работает
Попробую объяснить на примере. Область 2022, 10 кл.
У нас стабильнее заторможенная конформация, но если бы заслоненной не осталось, то процент заторможенной был бы 100%. Но почему-то у нас спрашивают их процентное содержание)
Попробуй решить эту задачу. Решение есть в kazolymp.kz
Угу, 99,22% этана в заторм. конф. Я правильно понимаю, вы хотите сказать что изменяются условия реакции и она уже не может протекать? (Ну я про А в Б)
На самом деле я сам до конца не понимаю, но этот пример показал что 100% чего-то точно не будет в равновесной системе (без округлений). Моя мысль: процентное содержание веществ будет предсказывать константа равновесия. Если константа больше одного (в примере константа равна 141.4[1]) то и продукта будет больше. Потому что константа равна продукты/реагенты . Обратимые реакции практически могут проходить 100 процентно, но 0.000000001% реагента все равно будет. Его просто настолько мало, что даже не берут в учет
-
там в решении ошибочка ↩︎
Ты ботал химическое равновесие в теормате Еремина? Она поможет понять получше логику равновесий. Тут просто все константа решает
Мысль уловил) но мне бы какую-нибудь причину по типу “все реагенты галактическим образом стабилизируют продукт” или типа того
Неа. Я вырос на всеросах. Начать ботать по книжкам только недавно в бошку залетело. Ну и читаю Клейдена)
Не совсем понятно. Это в книге так сказали?
Не, эт мои догадки
Ничего придумать не могу. Имхо, все решает константа равновесия
Энтропия всё портит, чем меньше остается вещества A, тем более “сладким” для термодинамики становится это A синтезировать
Если бы у тебя в газе шла реакция
То в какой-то момент исходного вещества стало бы так мало, что потеря вещества стоила бы нам целую кучу энтропии, а значит отделаться одной только стабильностью не выйдет, ведь мы не можем обманывать вселенную, и нам надо всегда проверять, чтобы изменение энтропии вселенной росло. При постоянном давлении и температуре, это условие равноценно условию отрицательности энергии Гиббса. А теперь вспомни или найди формулу, которая связывает энтропию газа от его давления и химический потенциал газа от его давления.
Физху не чалил, поэтому вот что я нашел
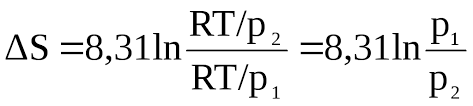
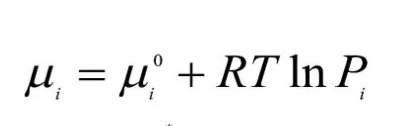
А почему? В какой книге могу это прочитать?
Начинай
График логарифма видел? Чем ближе давление к нулю, тем быстрее он улетает в минус, тебе за такое падение логарифма нужно будет чем-то платить, либо теплотой самой реакции (выкидывая её в окружающую среду), либо посторонней работой (как в электролизе).
Я прям надеялся что @Sammael даст ответ))
У меня была такая гипотеза (не уверен как можно это расчетами подтвердить). Что, мол, если есть равновесие \ce{A<=>B}, и В стабильнее А, то минимальное[1] отношение B/A определяется температурой (зависимость константы равновесия от температуры).
Но вопрос автора почему это отношение является еще и верхним порогом. И я тоже подумал что энтропия: раз мы можем себе позволить иметь определенное количество менее стабильной формы, будем ее иметь (ибо два разных вида молекул >(больше энтропия) чем один вид молекул).
Но вот можно ли это квантифицировать как-то? Та же формула смешения? \chi_1 \ln \chi_1 + \chi_2 \ln \chi_2 или что-то еще есть?
типа, температура определяет верхний порог количества менее стабильной формы ↩︎
Если формула смешения не работает, значит у нас не идеальный раствор и надо брать активности. Или я не понял твой вопрос.
Не, это понятно, я в общем спрашивал этой ли формулой (формой формулы лол) определяется стабилизация от присутствия двух форм равновесия, вместо одной
Если в изобарно-изотермических условиях, то с энергией Гиббса просто (совпадает с требованием максимума энтропии), кстати ситуация, когда один компонент просто исчез бывает при граничном экстремуме (ну там он твердым был, и его активность не менялась)
Вообще под символом \displaystyle \Delta_r G скрывается же производная системы от химической переменой \displaystyle \left( \frac{\partial G}{\partial \xi}\right)_{p,T} т.е. то самое, что считают девятикласснике на олимпиадах, уже ответ на твой вопрос, и там “форма формулы” ты знаешь какая, там вместо мольных долей коэффициенты из реакции стоят
А ну да, точно, если Q>K у нас \Delta_r G > 0. Гиббс уже включает эту энтропию)