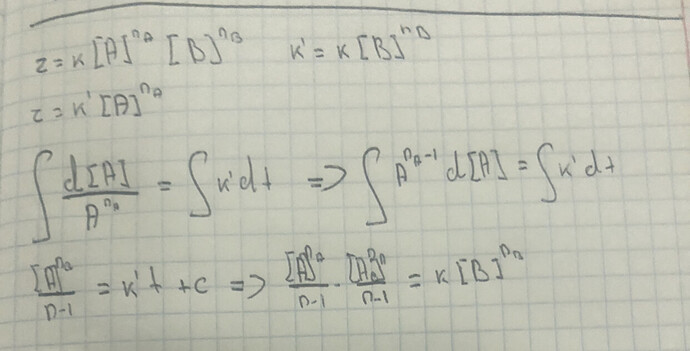Мне очень понравилась эта задача. То, что ты сказал про определение порядка по A почти верно, надо сделать только одну оговорку и тогда не будет претензий. В целом мы не можем брать, что у нас только три варианта (0, 1, 2) для порядка, потому что нет слов о том, что эта реакция простая или о том, что можно сделать такое пренебрежение. Но мы все равно можем знать чему равен период полураспада для второго порядка. Для начала введем несколько переменных:
\ce{\textit{n}_1A + \textit{n}_2B -> products}
r = k[A]^{a}[B]^{b}
Тогда период полураспада для второго порядка можно записать так:
\tau_{1/2} = \frac{1}{k_{\text{obs}} n_1 [A]_{0}}, \; k_{\text{obs}} = k[B]_{0}^{b}
Если обозначить штрихом (^{\prime}) эксперимент, в котором [A]_{0} = \pu{6 M}, то можно будет записать две формулы:
\tau_{1/2} = \frac{1}{k [B]_{0}^{b} \ n_1 [A]_{0}} \; \text{ и } \; \tau_{1/2}^{\prime} = \frac{1}{k [B]_{0}^{\prime b} n_1 [A]_{0}^{\prime}}
Тогда
\frac{ \tau_{1/2} }{ \tau_{1/2}^{\prime} } = \frac{ [A]_{0}^{\prime} }{ [A]_{0} } \cdot \frac{ [B]_{0}^{\prime b} }{ [B]_{0}^{b} }
Как видишь, нельзя сказать, что здесь зависимость только от А, но в задаче дается ключевое слово — избытки вещества В в обоих случаях одинаковы. Как я понимаю, это говорит о том, что [B]_{0}^{\prime b} = [B]_{0}^{b}. Вот теперь можно сказать, что порядок второй, потому что наблюдается обратная зависимость от [A]. Если бы я оценивал на олимпиаде по этой задаче, я бы не давал баллы тем, кто не объяснил все полностью.
Теперь найдем порядок по В (снова в общем случае, не делая каких-либо пренебрежений, которых нет в условии).
Для начала поймем, что нам дает факт о стехиометрическом соотношении веществ А и В. Само по себе это значит, что [A]_{0}/[B]_{0} = n_{1}/n_{2} (заметь, что мы все еще не можем сказать, что n_{1} = 2, потому что никто не говорил о том, что это простая реакция). В итоге мы можем вывести соотношение между концентрациями А и В в любой момент времени:
n_{2} ([A]_{0} - [A]) = n_{1} ([B]_{0} - [B])
n_{1}[B] = n_{1}[B]_{0} - n_{2} [A]_{0} + n_{2} [A] = n_2[A]
Тогда можно написать выражение для скорости расходования А:
- \frac{1}{ n_{1} } \frac{d[A]}{dt} = k [A]^{2} [B]^{b}
Из предыдущего факта можно преобразовать:
- \frac{1}{ n_{1} } \frac{d[A]}{dt} = k [A]^{2} \left( \frac{n_2}{n_1} \right)^{b} [A]^b
Теперь немного раскидаем переменные:
- \frac{d[A]}{ [A]^{b+2} } = k n_1 \left( \frac{n_2}{n_1} \right)^{b} dt
Есть два принципиально разных случая — когда b=-1 (оно может быть таким, потому что реакция может быть сложной) и когда b \neq -1. Начнем со второго случая. Тогда можно будет проинтегрировать последнее выражение:
\frac{1}{[A]^{b+1}} - \frac{1}{ [A]_{0}^{b+1} } = n_1 \left( \frac{n_2}{n_1} \right)^{b} (b+1) kt
И самое классное — давай теперь выведем формулу для периода полураспада в первом и втором экспериментах.
\tau_{1/2} = \frac{ 2^{b+1} - 1 }{ [A]_{0}^{b+1} } \cdot \frac{1}{n_1} \left( \frac{n_1}{n_2} \right)^{b} \frac{1}{b+1} \frac{1}{k}
\tau_{1/2}^{\prime} = \frac{ 2^{b+1} - 1 }{ [A]_{0}^{\prime b+1} } \cdot \frac{1}{n_1} \left( \frac{n_1}{n_2} \right)^{b} \frac{1}{b+1} \frac{1}{k}
Теперь можно верхнее уравнение поделить на нижнее:
\frac{ \tau_{1/2} }{ \tau_{1/2}^{\prime} } = \left( \frac{ [A]_{0}^{\prime} }{ [A]_{0} } \right)^{b+1} = 3^{b+1}
Решив уравнение, получим, что b=1. Поскольку не получилось, что b=-1, этот ответ можно брать за ответ задачи.
Попробуй дальше сам решить остальные пункты и спрашивай если еще будут проблемы.