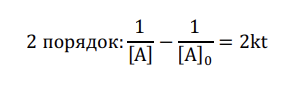
С Новым годом всех!
Задача 3 из Облыс 2022 11 класс
В решение дано это формула вроде двойка не должна быть так как при 2 порядки n-1 будет равен 1 и должно быть 1/[A]-1/[A]0=kt. Либо здесь ошибка или я что-то не учитываю. Помогите пожалуйста.
Если представить реакцию второго порядка, как
Тогда можем написать выражение для изменения концентрации А:
Проинтегрировав слева от [\ce{A}]_0 до [\ce{A}], а справа от 0 до t, получаем
Почему в учебниках справа стояло kt без двойки? Наверно заменяют 2k новой константой k
Если ты про теормат, просто в теормате дана формула для реакции А+B=C, при условии что [A]=[B] и получаетс дифф. уравнение без двойки, но во второй степени.
{ \frac{1}{[\ce{A}]}-\frac{1}{[\ce{A}]_0}=kt }
Все понятно спасибо
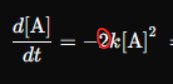
Теперь и мне не понятно, почему тут 2?
Одну и тоже скорость реакции можно расписать по разному - через закон действующих и масс скорость реакции по реагенту/продукту. Их можно приравнять и получится это уравнение. По началу там двойка будет снизу слева, потом обе стороны на 2 просто умножаем
I think this will be useful
Я наверное очень туплю, но я никак не понимаю откуда там должна быть 2 снизу слева?)
Смотри вот сталкиваются атомы двух веществ А и Б, дают вещество С, мы в кинетическом уравнении считаем изменение концентрации только А, условно изменилась концентрация на один А. Теперь у нас сталкиваются атомы одного вещества с друг другом А и А, дают вещество С, мы в кинетическом уравнении считаем изменение концентрации А, уже условно изменилась концентрация на два А. Вот и вдруг появившееся двойка выходит.
Афигеть
Я бы наверное никогда не допер
Спасибо большое всем)
Я сам в 11-ом классе только щяс допер
А получается для третьего порядка
d[A]/3dt = -k[A]^3?
Походу, вот только никогда не видел, чтобы где-то появлялись уравнение с более высоким порядком чем второй.
for example, we have a reaction 2A \rightarrow B
we have general formula for writing kinetic equations \frac{1}{a}\cdot\frac{d[A]}{dt}
a= coefficient in front of A
Okey, I understand
Thank you very much)
I am quite sure but it depends on the type of reacion
Если это реакция \ce{3A -> P}, то да:
В общем случае для \ce{nA -> P}:
Но если это реакция типа \ce{A + B + C-> P} при [A]_0=[B]_0=[C]_0, то