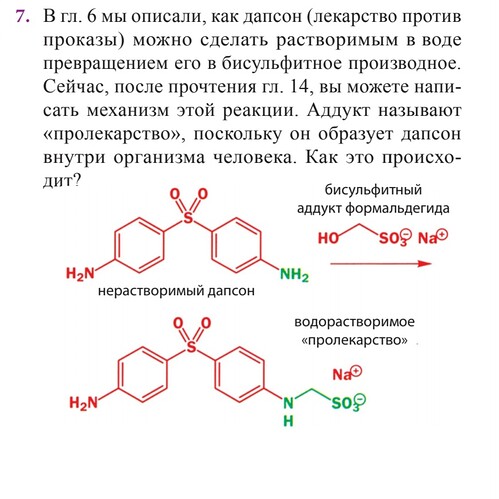
не совсем понимаю как идет эта реакция,там же сначала из бисульфитного производного должен поулчится формальдегид чтобы атом азота присоединялся к карбонильной группе? если да то дальше что? как потом возвращается SO3?
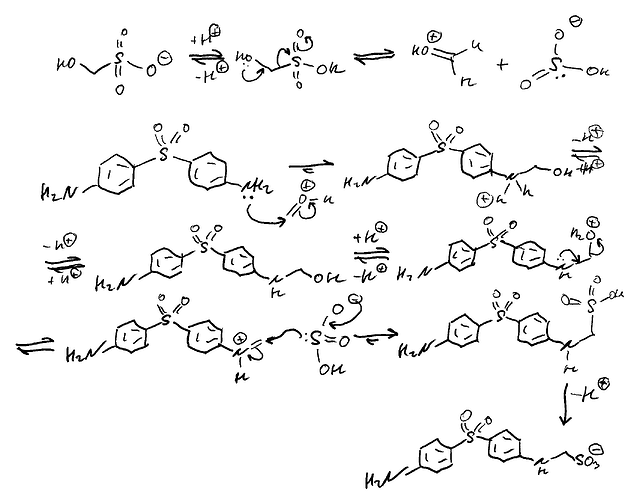
Думаю это просто S_N2 реакция, где гидроксильная группа - уходящая. Аминна группа действует как нуклеофил, и атакует углерод. В это же время гидроксильная группа уходит.
Плохая группа
А среду сделать кислой не вариант? А хотя тогда аминная тоже будет протонироваться…
Использовать два растворителя, где один будет неполярный, и в котором можно будет растворить дапсон. А рядрм второй полярный раствор, где будет растворен аддукт. Сделаем полярный раствор кислым, где гидроксильная и будет протонироваться, а на границах эти молекулы смогут прореагировать. А продукт, который получается, растворим в полярной, и переходит туда. И так до окончания концентрации дапсона.
Или бред? ![]()
тут в самом учебнике есть такое, в этой реакции тоже так? Только в примере с циангидрином в молекуле же OH остается… то есть потом идет SN2 реакция и SO3 присоединялся а OH должен уйти, я правильно понимаю?
среда же кислая чтобы уходящей группой было H2O?
поняла вроде,спасибо
Вставлю свои пять копеек.
Во-первых, идея про формальдегид весьма разумна, поскольку только он/его производное может выступать в роли электрофила, способного прореагировать с аминогруппой в ароматическом кольце, которая ещё и деактивирована электроноакцепторной сульфонной группой в пара-положении.
Во-вторых, отвечу на следующее утверждение:
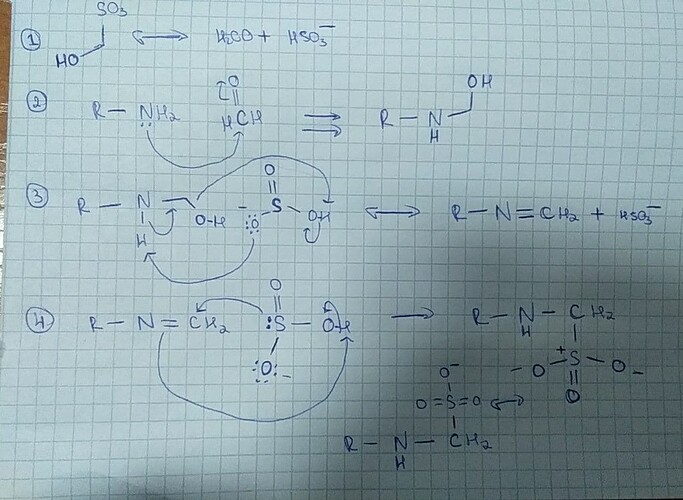
Лучший pH для образования иминов из карбонильных соединений и аминов это 4–5, поскольку при этих pH аминогруппа не протонируется и не теряет своей нуклеофильности, а карбонильная группа (в нашем случае формальдегида) может протонироваться и стать более сильным электрофилом, способным реагировать с достаточно слабо нуклеофильным ароматическим амином. По этой причине я бы сказал, что замечание про щелочной pH не совсем корректно, так как при щелочном pH формальдегид скорее прореагирует с OH^- с образованием гидрата, чем с нейтральным деактивированным амином. Корректный (на мой скромный взгляд) механизм прикреплю к этому сообщению.
В-третьих, дам общие комментарии по механизму, который предложил @DiNih.MiKao
- Стрелки влево-вправо \leftrightarrow используются для изображения резонансных структур, для равновесий лучше использовать \leftrightarrows .
- Не стоит пропускать стадии протонирования/депротонирования молекулы, они очень важны для понимания реакционной способности различных классов соединений! Так, соединение R\!-\!N\!=\!CH_2 вряд ли будет реагировать с гидросульфит-ионом, всё же HSO_3^- не слишком сильный нуклеофил, да ещё и мягкий. Чтобы эта реакция пошла, нужно превратить имин в основание Шиффа R\!-\!NH^+\!\!=\!CH_2, что может произойти только в кислом pH, да и, справедливости ради, основание Шиффа является интермедиатом на стадии образования имина, так что реакция с гидросульфитом может произойти раньше, чем депротонирование.
- Объединять стадии переноса протона в одну, как, например, было сделано на стадии 3, крайне не рекомендуется: не забывайте, что написанные так реакции протекали бы крайне медленно из-за невыгодной и маловероятной конформации переходного состояния, а также из-за того, что растворитель обычно реагирует гораздо быстрее, поскольку его банально больше и в отдельных случаях молекулы растворителя могут быстро передавать протоны по эстафетному механизму.
Предложенный механизм таков:
На стадиях с +H^+ и -H^+ протон передаётся к/от молекул растворителя или сопряженной ему кислоты/основания.
Как-то хочется докопаться. Если среда у нас кислая, то останется ли в конце \ce{SO3^-} ? Не должен ли быть продукт \ce{R-SO3H}?
p.s. этот богатырь заслуживает больше “вопрос решен”, можете ему кто-то поставить
Разумный вопрос! Для ответа на него нужно знать некоторые специфичные свойства сульфоновых кислот. Можно заметить, что по своей структуре сульфоновые кислоты очень похожи на гидросульфат-ион, у которого один из атомов кислорода заменили на органический радикал, в нашем случае –\!\text{CH}_2\!–\!\text{NH}\!–\text{Ar}. Значение константы диссоциации гидросульфат-аниона порядка 10^{-2}, даже для такого значения можно ожидать практически полного нахождения кислоты в форме аниона при pH \sim 4–5. Константы диссоциации сульфоновых кислот гораздо больше, чем K_{a,2} серной кислоты, во многом потому что они в недиссоциированной форме не заряжены, конкретно для метансульфоновой кислоты pK_a \approx -1.9, поэтому можно ожидать что при pH \sim 4–5 весь продукт будет в форме аниона. А вот почему константу диссоциации метансульфоновой кислоты можно использовать как нижнюю границу для константы диссоциации кислоты, являющейся сопряженной кислотой Брёнстеда для продукта, можете подумать на досуге.
А, ну и да, аналогичное рассуждение можно построить, если заменить не кислород в гидросульфате, а гидроксильную группу в серной кислоте, так можно быстро заметить, что константы диссоциации сульфоновых кислот должны быть порядка константы кислотности серной кислоты по первой ступени.
Кстати, в большинстве источников, второй причиной выбора такого рН(помимо протонирования амина при низком рН) является стадия протонирования интермедиата аминоспирта с последующей дегидратацией с образованием основания Шиффа. Протонирование гидроксильной группы проходит очень медленно при рН>6
о боже та задача с 1 тура менделя 2019 флешбеки