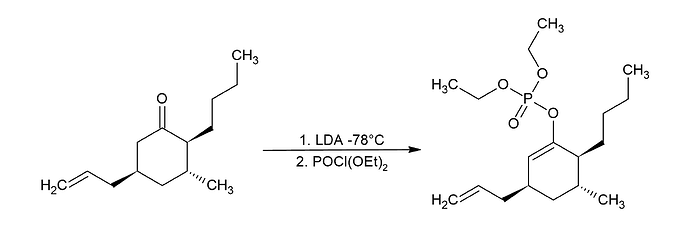
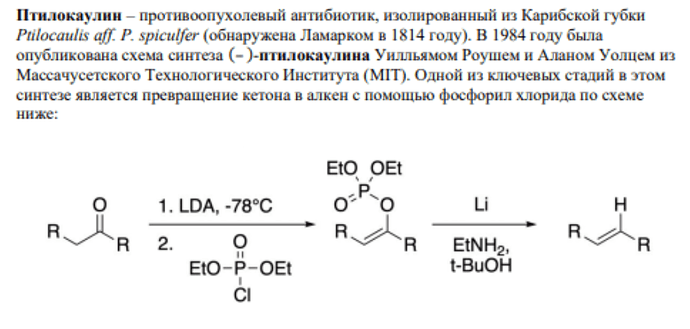
Решал задание респы 2020 года и возник вопрос по стадии превращения кетона в замещенный алкен. Не могу понять, почему двойная связь образуется менее замещенная, что кинетически невыгодно насколько я знаю. И даже если мои рассуждения не верны, то как можно было догадаться до истинного механизма, если в примере этой реакции не показано этого?
Здравствуй! Можешь обосновать?
читал в McMurry что двойная связь всегда стремится быть более замещенной
Я про “кинетически невыгодно”. Понимаешь что это значит?
точно не знаю, думал что если связанно с механизмом то так называется. Это не так?
А… ну…
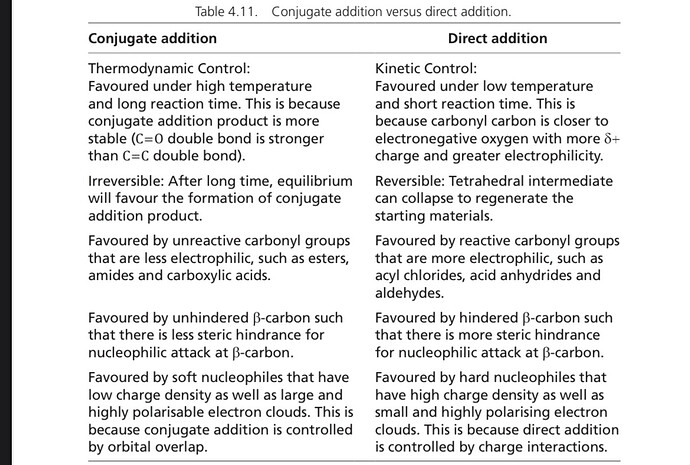
Кинетика <=> скорость реакций. Кинетический контроль - это когда проходит самая быстрая реакция, то есть реакция с наименьшей энергией активации.
Термодинамика <=> энергетика(dG) реакций. Термодинамический контроль - образуется более стабильный продукт (с наименьшей энергией).
В нашей реакции сначала добавляют LDA при температуре -78°С, образуется либо менее замещенный, либо более замещенный енолят, который потом будет реагировать с фосфором. То есть замещенность двойной связи определяется еще в реакции с LDA. При такой низкой температуре термодинамического контроля не будет, будет проходить самая быстрая реакция. Какая по твоему реакция быстрее, образования менее замещенного енолята, или образование более замещенного енолята?
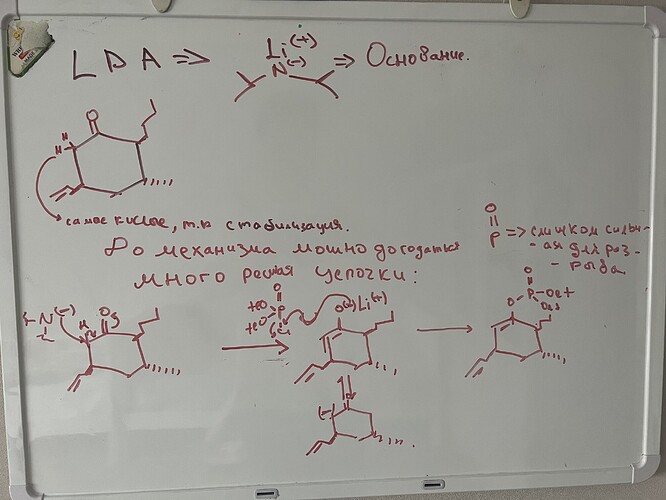
Даже если брать во внимание отсутствие термодинамического контроля, LDA должен отщеплять тот кислый протон, который легче уйдет. Если смотреть на вещество, то мне кажется, что быстрее всего уйдет протон слева. Но тогда почему в примере самой реакции образуется тот продукт, который противоречит этой логике? (если к примеру взять, что радикал - метил)
Ну во-первых, протон который рядом с кетоном является кислее тут, потому что тут есть стабилизация за счет кислорода.
Во-вторых, ты знаком с теорией ЖМКО ? В теории ЖМКО у нас Li это жесткий металл, соответственно ему будет хорошо закрепится прямо на кислород
Это менее стабильно, однако тут будет кинетический контроль. Если бы у нас было бы сопряжение с карбонильной группой через двойную связь, то реагент который называется Гильман реагент, атаковал бы по ней, потому что медь мягкий металл и ему будет лучше связаться с углеродом
Механизм и то, как до него можно было догадаться
А если изо-пропил? Теперь не противоречит? В механизме пытались показать общую реакцию. Там, как ты видишь, можно предположить и тот и дркгой вариант. Ты ведь не знаешь кого они имеют ввиду под R. Но метил один, а радикалов третичных очень много, а слева у нас точно вторичный углерод. Я не вижу тут противоречий.
Ты же понимаешь как это связано со скоростью реакции, да? А так верно, но надеюсь у тебя не прямая логика “легче оторвать - быстрее идет реакция”. Опять же, происходит самая быстрая реакция.
красиво
Если бы там был метил, то протон забирали бы у него, да. Но с тем же успехом там может быть не метил, а фенил. В механизме вам просто показывают, что для реакции нужна а) C=O группа б) кислый протон рядом с ним, а все остальное не важно (поэтому и заменено на R). Никаких выводов о региоселективности в показанном механизме делать не пытаются.
при прочих равных, термодинамически она более стабильна. Но тут важно заметить, что если двойная связь будет справа от карбонила, вот эта огромная фосфатная группа и н-бутильная будут вынуждены находиться в одной плоскости, что будет создавать дестабилизирующие стерические взаимодействия.