Как понять когда надо использовать уравнение идеального газа а когда не идеального ?
Вроде бы в задачах об этом должны упоминать
- Если газ неидеальный, то будет что-то вроде
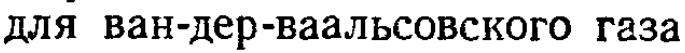
- Если газ идеальный, то будет так и написано, что газ можно считать идеальным
В феноменологической термодинамике есть как бы “основной набор” законов и уравнений, которые работают в общем случае для любого вещества (нередко есть и некоторые оговорки о типе вещества), но при этом есть определённые частные случаи их применения. Ниже я постараюсь привести как можно больше примеров такого:
-
Первый закон термодинамики. В общем виде записывается как \delta Q = \text{d}A + \text{d}U. Этот закон выражает закон сохранения энергии, и имеет особенную практическую пользу для изолированных систем
-
Работа \text{d}A=P\text{d}V является обобщённой формулой, работает она в принципе везде (её довольно простой вывод есть в книжках). Здесь P является собственным давлением вещества, если работа совершается при квазистатическом расширении, то собственное давление и внешнее равны по модулю (P+P_{ex}=0), то работа внешних сил \text{d}A_{ex}=-P_{ex}\text{d}V. Можно и отбросить тут минус, но тогда надо вводить поправки в другие уравнения (например, записывать первое начало термодинамики в привычный химикам вид Q=U-A). Переходя в частный случай идеального газа, то можно писать, к примеру, PV=\nu RT и выражать P через другие величины, чтобы интегрировать работу.
-
А теперь здесь конкретно об идеальном газе: dU=d(C_VT) тоже работает в общем случае, теплоёмкость при постоянном объёме C_V внесена в дифференциал, так как она может быть функцией других величин (температуры, количества вещества, …). Но если речь идёт об идеальном газе, тогда зачастую сначала делается предположение, что C_V=const и затем C_V=\displaystyle\frac{\nu R}{\gamma-1}. Таким образом, внутренняя энергия фиксированного моля идеального газа зависит только от температуры.
-
Могу упомянуть и различные термодинамические функции (энтропия, энтальпия, свободная энергия и прочее), и они введены как определённая комбинация характеристик вещества (к примеру, энтальпия есть U+PV). С ними можно получать некоторые соотношения для любого вещества (как, например, наиболее часто применяемая формула \displaystyle\left(\frac{\text{d}U}{\text{d}V}\right)_T=T\left(\frac{\text{d}P}{\text{d}T}\right)_V - P), и для идеального газа тоже можно получить результаты их применения, если для каких-либо величин сделать замену с использованием PV=\nu RT или U=C_VT.
-
Уравнение адиабаты PV^\gamma=const, если оно и упоминается в задачах, работает только для идеального газа. Но можно, например, доказать, что для фотонного газа это уравнение имеет вид PV^{4/3}=const, но сочтём это за простое совпадение))
Этот список можно продолжать до бесконечности, но, надеюсь, ты понял общую закономерность.
Идеальный газ является самой простой моделью газа, но как известно, есть и другие. О ван-дер-ваальсовском как раз упомянул @Damir. Но тем не менее, практически все задачи на термодинамику газов используют модель идеального, а если упомянуто иное, то обязательно говорится, что газ ван-дер-ваальсовский. Дело в том, что модель Ван-дер-ваальса качественно исследует такие явления, как конденсация, испарение, перегрев, пересыщение, и я сам не видел таких задач, в которых эта модель нужна просто для того, чтобы более точно вычислять искомые величины.