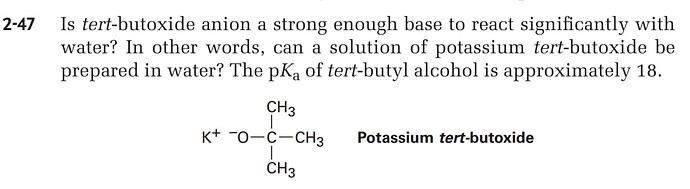
В ответе говориться, что терт бутооксид калия не будет растворяться в воде потому что: вода является намного кислее чем терт бутооксид калия. Ну почему именно дело в pH? Какие другие факторы влияют?
Или дело в том, что от слабой щелочи не может образоваться сильная щелочь?
Просто в главах про предсказывание кислотно-щелочных реакций говорилось вот так:
вода кислее терт бутанола , значит (ОН-) стабильнне бутоксид-аниона, значит с бутоксид анионами будет происходить что-то такое
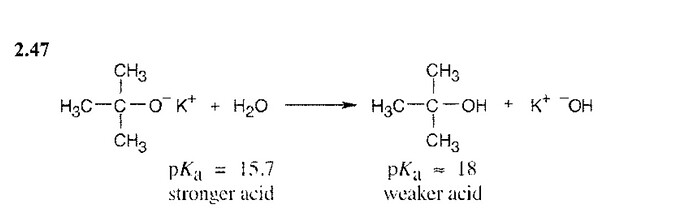
BuO(-)+H2O<=>BuOH+OH(-)
Дело не в pH, вы читаете главу, которая вам вообще не по зубам. Вам необходимо разобраться в кислотно-основных равновесиях, вы решали задачи на аналитику на эту тему?
Только с теормата, глава: ионные равновесие
Неправильно выразился.
Я все еще в процессе освоение темы)
у вас тут кстати та же самая схема, что и в книге,
stronger acid -h2o
stronger base -t-BuO(-)
weaker acid - t-BuOH
weaker base - OH(-)
это и есть 2 глава в макмурри)
У автора вопроса полнейшая беда с терминологией.
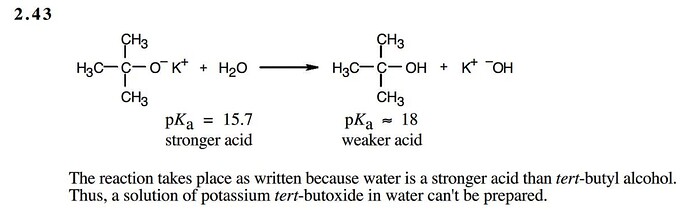
Для понимания, вот что пишут в решении:
Т.е. тут говорят:
а. реакция протекает вправо
б. раствор тертбутилоксида в воде не может быть приготовлен. Почему? Потому что тертбутилоксид будет реагировать с водой и мы будем получать раствор тертбутанола.
О растворимости здесь речи не шло.
Что-то за сегодня я реально так поплыл. В следующий раз постараюсь внимательнее понимать суть. А так спасибо!